工业生产Na2S常用方法是无水芒硝(Na2SO4)一碳还原法,其流程示意图如下: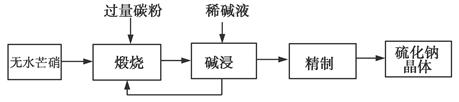
(1)若煅烧阶段所得气体为等物质的量的CO和CO2。写出煅烧时发生的总反应方程式:______________________。
(2)用碱液浸出产品比用热水更好,理由是__________________。
(3)废水中汞常用硫化钠除去,汞的除去率与溶液pH和硫化钠实际用量与理论用量比值x的关系如图所示。为使除汞达到最佳效果,应控制条件是________________。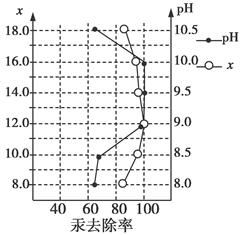
(4)取Na2S(含少量NaOH),加入到CuSO4溶液中,充分搅拌,若反应后溶液pH=4,此时溶液中c(S2-)=________mol·L-1[已知:CuS的Ksp=8.8×10-36;Cu(OH)2的Ksp=2.2×10-20(保留2位有效数字)]。
(5)纳米Cu2O常用电解法制备,制备过程用铜棒和石墨棒做电极,Cu(NO3)2做电解液。电解生成Cu2O应在________;该电极pH将________(填“升高”“不变”或“降低”),用电极方程式解释pH发生变化的原因______________________。
钛冶炼厂与氯碱厂、甲醇厂组成一个产业链(如图所示),将大大提高资源的利用率,减少环境污染。
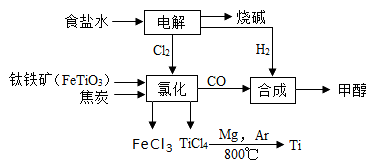
请回答下列问题:
(1)Fe位于元素周期表中第________________周期,第_______________族。
(2)写出钛铁矿在高温下与焦炭经氯化得到四氯化钛的化学方程式 。
(3)制备TiO2的方法之一是利用TiCl4水解生成TiO2·x H2O,再经焙烧制得。水解时需加入大量的水并加热,请结合化学方程式和必要的文字说明原因:
(4)反应后得到Mg、MgCl2、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据下表信息,需加热的温度略高于 ℃即可。
| |
TiCl4 |
Mg |
MgCl2 |
Ti |
| 熔点/℃ |
-25.0 |
648.8 |
714 |
1667 |
| 沸点/℃ |
136.4 |
1090 |
1412 |
3287 |
(5)用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。滴定分析时,称取TiO2(摩尔质量为M g/mol)试样w g,消耗c mol/L NH4Fe(SO4)2标准溶液V mL,则TiO2质量分数为___________________。(用代数式表示)
(6)由CO和H2合成甲醇的方程式是:CO(g)+2H2(g) CH3OH(g)。若不考虑生产过程中物质的任何损失,上述产业链中每合成6mol甲醇,至少需额外补充H2 mol。
CH3OH(g)。若不考虑生产过程中物质的任何损失,上述产业链中每合成6mol甲醇,至少需额外补充H2 mol。
重铬酸钠(Na2Cr2O7•2H2O)俗称红矾钠,在工业上有广泛的用途。我国目前主要是以铬铁矿(主要成份为FeO•Cr2O3,还含有Al2O3、MgO、SiO2等杂质)为主要原料进行生产,其主要工艺流程如下:
①中涉及的主要反应有:
主反应: 4FeO·Cr2O3+8Na2CO3+7O2  8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2
副反应:SiO2+Na2CO3 Na2SiO3+CO2↑、Al2O3+Na2CO3
Na2SiO3+CO2↑、Al2O3+Na2CO3 2NaAlO2+CO2↑
2NaAlO2+CO2↑
部分阳离子以氢氧化物形式完全沉淀时溶液的pH:
| 沉淀物 |
Al(OH)3 |
Fe(OH)3 |
Mg(OH)2 |
Cr(OH)3 |
| 完全沉淀时溶液pH |
4.7 |
3.7 |
11.2 |
5.6 |
试回答下列问题:
(1)“①”中反应是在回转窑中进行,反应时需不断搅拌,其作用是 。
(2)“③”中调节pH至4.7,目的是 。
(3)“⑤”中加硫酸酸化的目的是使CrO42-转化为Cr2O72-,请写出该平衡转化的离子方程式: 。
(4)制取红矾钠后的废水中还含有少量的CrO42-,根据有关标准,含CrO42-的废水要经化学处理,使其浓度降至5.0×10-7 mol·L-1以下才能排放。含CrO42-的废水处理可用还原法:
CrO42- Cr3+
Cr3+ Cr(OH)3。绿矾还原CrO42-的离子方程式为:
Cr(OH)3。绿矾还原CrO42-的离子方程式为:
。
用该方法处理10 m3 CrO42-的物质的量浓度为1.5×10-3 mol·L-1的废水,至少需要绿矾(FeSO4•7H2O,相对分子质量为278)的质量是 Kg(保留两位小数)。
步骤⑦的操作是 。为进一步得到较为纯净的红矾钠的操作是
红矾钠(重铬酸钠:Na2Cr2O7·2H2O)是重要的基本化工原料,在印染工业、电镀工业和皮革工业中做辅助剂,在化学工业和制药工业中也可做氧化剂,应用领域十分广泛。实验室中红矾钠可用一种铬铁矿(主要成分:FeO·Cr2O3,还含有少量的Al2O3)通过以下过程来制取。
回答下列问题:
(1)步骤Ⅰ中反应化学方程式为4FeO2·Cr2O3(s)+8Na2CO3(s)+7O2(g)=8Na2CrO4(s)+2Fe2O3(s)+8CO2(g)。
①在实验室,步骤Ⅰ应在________(填“陶瓷”或“铁”)坩埚中完成。
②在常温下该反应速率极慢,下列措施中能使反应速率增大的是________(填字母)。
A.将原料粉碎 B.增加纯碱的用量 C.升高温度
(2)步骤Ⅱ中NaOH的作用是________________________(用化学反应方程式表示)。
(3)步骤Ⅳ中发生反应的离子方程式为________;反应完成的标志是________。
(4)利用下面的复分解反应,将红矾钠与KCl固体按12物质的量之比混合溶于水后经适当操作可得到K2Cr2O7晶体:Na2Cr2O7+2KCl=K2Cr2O7+2NaCl(已知:温度对氯化钠的溶解度影响很小,对重铬酸钾的溶解度影响较大)
基本实验步骤为①溶解;②________;③________;④冷却,结晶,再过滤得K2Cr2O7晶体。其中③应在________(填“高温”或“低温”)条件下进行。
硅藻土是由硅藻死亡后的遗骸沉积形成的,主要成分是 SiO2和有机质,并含有少量的Al2O3、Fe2O3、MgO 等杂质。精制硅藻土因为吸附性强、化学性质稳定等特点被广泛应用。下图是生产精制硅藻土并获得Al(OH)3的工艺流程。
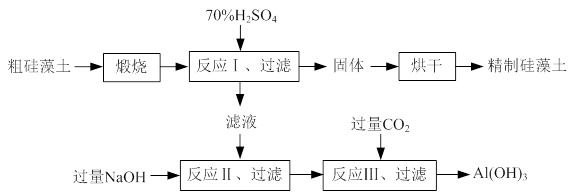 ⑴粗硅藻土高温煅烧的目的是 。
⑴粗硅藻土高温煅烧的目的是 。
⑵反应Ⅲ中生成Al(OH)3沉淀的化学方程式是 ;氢氧化铝常用作阻燃剂,其原因是 。
⑶实验室用酸碱滴定法测定硅藻土中硅含量的步骤如下:
步骤1:准确称取样品a g,加入适量KOH固体,在高温下充分灼烧,冷却,加水溶解。
步骤2:将所得溶液完全转移至塑料烧杯中,加入硝酸至强酸性,得硅酸浊液。
步骤3:向硅酸浊液中加入NH4F溶液、饱和KCl溶液,得K2SiF6沉淀,用塑料漏斗过滤并洗涤。
步骤4:将K2SiF6转移至另一烧杯中,加入一定量蒸馏水,采用70 ℃水浴加热使其充分水解(K2SiF6+3H2O=H2SiO3+4HF+2KF)。
步骤5:向上述水解液中加入数滴酚酞,趁热用浓度为c mol·L-1 NaOH的标准溶液滴定至终点,消耗NaOH标准溶液VmL。
①步骤1中高温灼烧实验所需的仪器除三角架、泥三角、酒精喷灯外还有 。
a.蒸发皿 b.表面皿 c.瓷坩埚 d.铁坩埚
②实验中使用塑料烧杯和塑料漏斗的原因是 。
③步骤3中采用饱和KCl溶液洗涤沉淀,其目的是 。
④步骤5中滴定终点的现象为 。
⑤样品中SiO2的质量分数可用公式“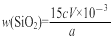 ×100%”进行计算。由此分析步骤5中滴定反应的离子方程式为 。
×100%”进行计算。由此分析步骤5中滴定反应的离子方程式为 。
氯化亚铜(CuCl)是白色粉末,微溶于水,不溶于乙醇,在空气中会被迅速氧化成绿色碱式盐。从酸性电镀废液(主要含Cu2+、Fe3+)中制备氯化亚铜的工艺流程图如下:
金属离子含量与混合液pH、CuCl产率与混合液pH的关系图如图。
【已知:金属离子浓度为1 mol·L-1时,Fe(OH)3开始沉淀和沉淀完全的pH分别为1.4和3.0,Cu(OH)2开始沉淀和沉淀完全的pH分别为4.2和6.7】请回答下列问题:
(1)酸浸时发生反应的离子方程式是________;析出CuCl晶体时的最佳pH在________左右。
(2)铁粉、氯化钠、硫酸铜在溶液中反应生成CuCl的离子反应方程式为____________________________。
(3)析出的CuCl晶体要立即用无水乙醇洗涤,在真空干燥机内于70℃干燥2 h、冷却密封包装。70℃真空干燥、密封包装的目的是____________________________________________。
(4)产品滤出时所得滤液的主要分成是________,若想从滤液中获取FeSO4·7H2O晶体,还需要知道的是__________________。
(5)若将铁粉换成亚硫酸钠也可得到氯化亚铜,试写出该反应的化学方程式:______________________。为提高CuCl的产率,常在该反应体系中加入稀碱溶液,调节pH至3.5。这样做的目的是__________________________________________。
三氯化铬是化学合成中的常见物质,三氯化铬易升华,在高温下能被氧气氧化。制备三氯化铬的流程如下图所示:
(1)重铬酸铵分解产生的三氧化二铬(Cr2O3难溶于水)需用蒸馏水洗涤,如何用简单方法判断其已洗涤干净? 。
(2)已知CCl4沸点为76.8℃,为保证稳定的CCl4气流,适宜的加热方式是 。
(3)用下图装置制备CrCl3时,
反应管中发生的主要反应为: Cr2O3+3CCl4==2CrCl3+3COCl2,则向三颈烧瓶中通入N2的作用为:
① ;
② 。
(4)样品中三氯化铬质量分数的测定:称取样品0.3000g,加水溶解并定容于250mL容量瓶中。移取25.00mL于碘量瓶(一种带塞的锥形瓶)中,加热至沸后加入1g Na2O2,充分加热煮沸,适当稀释,然后加入过量2mol·L–1H2SO4至溶液呈强酸性,此时铬以Cr2O72–存在,再加入1.1g KI,加塞摇匀,充分反应后铬以Cr3+存在,于暗处静置5min后,加入1mL指示剂,用0.0250mol·L–1标准Na2S2O3溶液滴定至终点,平行测定三次,平均消耗标准Na2S2O3溶液21.00mL。(已知:2Na2S2O3+I2 == Na2S4O6+2NaI)
①滴定实验可选用的指示剂名称为 ,判定终点的现象是 ;若滴定时振荡不充分,刚看到局部变色就停止滴定,则会使样品中无水三氯化铬的质量分数的测量结果 (填“偏高”“偏低”或“无影响”)。
②加入Na2O2后要加热煮沸,其主要原因是 。
③加入KI时发生反应的离子方程式为 。
④样品中无水三氯化铬的质量分数为 。(结果保留一位小数)
钛铁矿的主要成分为FeTiO3(可表示为FeO·TiO2),含有少量MgO、CaO、SiO2等杂质。利用钛铁矿制备锂离子电池电极材料(钛酸锂Li4Ti5O12和磷酸亚铁锂LiFePO4)的工业流程如图所示:
已知:FeTiO3与盐酸反应的离子方程式为FeTiO3+4H++4Cl-=Fe2++TiOCl42—+2H2O
(1)化合物FeTiO3中铁元素的化合价是________。
(2)滤渣A的成分是________。
(3)滤液B中TiOCl42—转化生成TiO2的离子方程式是________________。
(4)反应②中固体TiO2转化成(NH4)2Ti5O15溶液时,Ti元素的浸出率与反应温度的关系如图所示。反应温度过高时,Ti元素浸出率下降的原因是________________________________。
(5)反应③的化学方程式是________________________。
(6)由滤液D制备LiFePO4的过程中,所需17%双氧水与H2C2O4的质量比是________。
(7)若采用钛酸锂(Li4Ti5O12)和磷酸亚铁锂(LiFePO4)做电极组成电池,其工作原理为Li4Ti5O12+3LiFePO4 Li7Ti5O12+3FePO4,该电池充电时阳极反应式是____________________。
Li7Ti5O12+3FePO4,该电池充电时阳极反应式是____________________。
利用钛白工业的副产品FeSO4(含少量重金属离子)可以生产电池级高纯超微细草酸亚铁。其工艺流程如下:
已知:①5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O
②5C2O42-+2MnO4-+16H+═10CO2↑+2Mn2++8H2O
(1)沉淀过程的反应温度为40℃,温度不宜过高的原因除了控制沉淀的粒径外,还有___________;
(2)滤液经处理可得到副产品___________;
(3)实验室测定高纯超微细草酸亚铁组成的步骤依次为:
步骤1:准确称量一定量草酸亚铁样品,加入25mL 2mol/L的H2SO4溶解
步骤2:用0.2000mol/L标准KMnO4溶液与其反应,消耗其体积30.40mL。
步骤3:向滴定后的溶液中加入2g Zn粉和5mL 2mol/L的H2SO4溶液,将Fe3+还原为Fe2+
步骤4:过滤,滤液用上述标准KMnO4溶液进行反应,消耗溶液10.00mL.
则样品中C2O42-的物质的量为__________;(写出计算过程);
(4)将一定量高锰酸钾溶液与酸化的草酸亚铁溶液混合,测得反应液中Mn2+的浓度随反应时间t的变化如图,其变化趋势的原因可能为__________;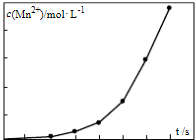
(10分)碳酸铈[Ce2(CO3)3]为白色粉末,难溶于水,主要用作生产铈的中间化合物。它可由氟碳酸铈精矿经如下流程。
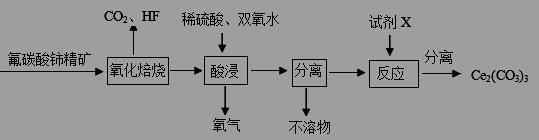
(1)氟碳酸铈的化学式为为CeFCO3,该化合物中,Ce的化合价为 。
(2)氧化焙烧生成的铈化合物为二氧化铈(CeO2),其在酸浸时发生反应的离子方程式为 。
(3)试剂X是 。
(4)若试剂X改为氢氧化钠溶液,则反应生成难溶物—一氢氧化铈(Ⅲ),其暴露于空气中时变成紫色,最终变成黄色的氢氧化高铈(Ⅳ)。氢氧化铈在空气中被氧化成氢氧化高铈的化学方程式为 。
(5)取(4)中得到的Ce(OH)4产品(质量分数为97%)1.00 g,加硫酸溶解后,用0.1000mol·L-1的FeSO4溶液滴定至终点(铈被还原成Ce3+),则需要滴加标准溶液的体积为 mL。
柠檬酸亚铁(FeC6H6O7)是一种易吸收的高效铁制剂,可由绿矾(FeSO4·7H2O)通过下列反应制备:
FeSO4+Na2CO3=FeCO3+Na2SO4
FeCO3+C6H8O7=FeC6H6O7+CO2+H2O
下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
| 金属离子 |
开始沉淀的pH |
沉淀完全的pH |
| Fe3+ |
1.1 |
3.2 |
| Al3+ |
3.0 |
5.0 |
| Fe2+ |
5.8 |
8.8 |
(1)制备FeCO3时,选用的加料方式是________(填字母),原因是_________________________________
a.将FeSO4溶液与Na2CO3溶液同时加入到反应容器中
b.将FeSO4溶液缓慢加入到盛有Na2CO3溶液的反应容器中
c.将Na2CO3溶液缓慢加入到盛有FeSO4溶液的反应容器中
(2)生成的FeCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是_______________________________。
(3)将制得的FeCO3加入到足量柠檬酸溶液中,再加入少量铁粉,80℃下搅拌反应。
①铁粉的作用是_____________________。
②反应结束后,无需过滤,除去过量铁粉的方法是________________________________。
(4)最后溶液经浓缩、加入适量无水乙醇、静置、过滤、洗涤、干燥,获得柠檬酸亚铁晶体。分离过程中加入无水乙醇的目的是__________________。
(5)某研究性学习小组欲从硫铁矿烧渣(主要成分为Fe2O3、SiO2、Al2O3)出发,先制备绿矾,再合成柠檬酸亚铁。请结合右图的绿矾溶解度曲线,补充完整由硫铁矿烧渣制备FeSO4·7H2O晶体的实验步骤(可选用的试剂:铁粉、稀硫酸和NaOH溶液):向一定量烧渣中加入足量的稀硫酸充分反应,________,得到FeSO4溶液,________,得到FeSO4·7H2O晶体。
氧化锌为白色粉末,可用于湿疹、癣等皮肤病的治疗。纯化工业级氧化锌[含有Fe(Ⅱ)、Mn(Ⅱ)、Ni(Ⅱ)等杂质]的流程如下:

提示:在本实验条件下,Ni(Ⅱ)不能被氧化;高锰酸钾的还原产物是MnO2。
回答下列问题:
(1)反应②中除掉的杂质离子是__________,发生反应的离子方程式为__________;在加高锰酸钾溶液前,若pH较低,对除杂的影响是________________。
(2)反应③的反应类型为____________,过滤得到的滤渣中,除了过量的锌外还有______________。
(3)反应④形成的沉淀要用水洗,检验沉淀是否洗涤干净的方法是________________。
(4)反应④中产物的成分可能是ZnCO3·xZn(OH)2,取干燥后的滤饼11.2 g,煅烧后可得到产品8.1 g,则x等于__________。
利用废旧镀锌铁皮可制备磁性Fe3O4胶体粒子及副产物ZnO。制备流程图如下:
已知:Zn及其化合物的性质与Al及其化合物的性质相似,请回答下列问题:
(1)用NaOH溶液处理废旧镀锌铁皮的作用有________。
| A.去除油污 | B.溶解镀锌层 | C.去除铁锈 | D.钝化 |
(2)调节溶液A的pH可产生Zn(OH)2沉淀,为制得ZnO,后续操作步骤是________。
(3)由溶液B制取Fe3O4胶体粒子的过程中,须持续通入N2,其原因是
_______________________________________________________________
(4)Fe3O4胶体粒子能否用减压过滤法实现固液分离?__________(填“能”或“不能”),理由是________________________________。
(5)用重铬酸钾法(一种氧化还原滴定法)可测定产物Fe3O4中的二价铁含量。若需配制浓度为0.010 00 mol·L-1的K2Cr2O7标准溶液250 mL,应准确称取________ g K2Cr2O7(保留4位有效数字,已知MK2Cr2O7=294.0 g·mol-1)。配制该标准溶液时,下列仪器中不必要用到的有________(用编号表示)。
①电子天平 ②烧杯 ③量筒 ④玻璃棒
⑤容量瓶 ⑥胶头滴管 ⑦移液管
(6) 滴定操作中,如果滴定前装有K2Cr2O7标准溶液的滴定管尖嘴部分有气泡,而滴定结束后气泡消失,则测定结果将________(填“偏大”、“偏小”或“不变”)。
七水硫酸镁(MgSO4•7H2O)在印染、造纸和医药等工业上都有广泛的应用,利用化工厂生产硼砂的废渣﹣硼镁泥可制取七水硫酸镁。硼镁泥的主要成分是MgCO3,还含有其他杂质(MgO、SiO2、Fe2O3、FeO、CaO、Al2O3、MnO等).
表1 部分阳离子以氢氧化物形式完全沉淀时溶液的pH
| 沉淀物 |
Al(OH)3 |
Fe(OH)3 |
Fe(OH)2 |
Mn(OH)2 |
Mg(OH)2 |
| pH值 |
5.2 |
3.2 |
9.7 |
10.4 |
11.2 |
表2 两种盐的溶解度(单位为g/100g水)
| 温度/℃ |
10 |
30 |
40 |
50 |
60 |
| CaSO4 |
0.19 |
0.21 |
0.21 |
0.20 |
0.19 |
| MgSO4•7H2O |
30.9 |
35.5 |
40.8 |
45.6 |
/ |
硼镁泥制取七水硫酸镁的工艺流程如下:

根据以上流程图并参考表格pH数据和溶解度数据,试回答下列问题:
(1)过滤I的滤液中加入硼镁泥,调节溶液的pH=5~6,再加入NaClO溶液加热煮沸,将溶液中的Mn2+氧化成MnO2,反应的离子反应方程式为 .加热煮沸的主要目的是 .
(2)沉淀B中除MnO2、SiO2外还含有 (填化学式)等物质.
(3)检验过滤Ⅱ后的滤液中是否含有Fe3+的实验方法是 ;
(4)沉淀C的化学式是 .过滤Ⅲ需趁热过滤的理由是 .
氧化镁在医药、建筑等行业应用广泛。硫酸镁还原热解制备高纯氧化镁是一种新的探索。以菱镁矿(主要成分为MgCO3,含少量FeCO3)为原料制备高纯氧化镁的实验流程如下:
(1)MgCO3与稀硫酸反应的离子方程式为_______________________________________
(2)加入H2O2氧化时,发生反应的化学方程式为____________________________
(3)滤渣2的成分是________(填化学式)。
(4)煅烧过程存在以下反应:
2MgSO4+C 2MgO+2SO2↑+CO2↑
2MgO+2SO2↑+CO2↑
MgSO4+C MgO+SO2↑+CO↑
MgO+SO2↑+CO↑
MgSO4+3C MgO+S↑+3CO↑
MgO+S↑+3CO↑
利用下图装置对煅烧产生的气体进行分步吸收或收集。
①D中收集的气体是________(填化学式)。
②B中盛放的溶液可以是________(填字母)。
a.NaOH溶液 b.Na2CO3溶液c.稀硝酸 d.KMnO4溶液
③A中得到的淡黄色固体能与热的NaOH溶液反应,产物中元素的最高价态为+4,写出该反应的离子方程式:____________________。