矿泉水一般是由岩石风化后被地下水溶解其中可溶部分生成的。此处所指的风化作用是指矿物与水和CO2同时作用的过程。例如钾长石(KAlSi3O8)风化生成高岭土〔Al2Si2O5(OH)4〕,此反应的离子方程式为2KAlSi3O8+2CO2+11H2O====2K++2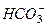 +4H4SiO4+Al2Si2O5(OH)4,这个反应能够发生的原因是____________________________。
+4H4SiO4+Al2Si2O5(OH)4,这个反应能够发生的原因是____________________________。
( 14 分)在元素周期表中,锌(30Zn)、镉(48Cd)、汞(80Hg)同属于锌族,锌和汞在自然界中常共生,镉的金属活动性介于锌和汞之间。湿法炼锌过程中产生的铜镉渣中含有Cu、Cd、Zn等多种金属,可用于生产金属镉。镉的主要用途可以用作镍―镉电池,以及用于颜料生产,镉化合物还在PVC稳定剂、发光材料、半导体材料、杀菌剂等方面有广泛的应用。镉的生产流程如图示意如下: 请回答下列问题:
请回答下列问题:
(1)镉元素位于周期表中第 周期,第 族,其原子结构示意图为 ;
(2)写出步骤①反应的离子方程式 。
(3)步骤②所加入的金属是 。
(4)步骤④用“溶液2”作电解液,镉在 极析出,该电极材料是
(5)“电解废液”中含有镉,不能直接作为污水排放。目前含镉的废水处理的方式有两种,一种是在含镉污水中加入硫化钠,沉淀镉离子,另一种是加入聚合硫酸铁和聚合氯化铝,沉淀镉离子。写出硫化钠沉淀镉离子的离子方程式 。
分子由____________基和____________基构成的物质称为表面活性剂.根据在水溶液中电离出的表面活性微粒所带电荷的不同,表面活性剂分为____________、____________、____________和____________。
2004年10月1日,南昌八一广场以全新的面貌重新向市民开放,成为南昌的一大亮点。在这次改造扩建的过程中采用了大量的花岗石(不与常见酸反应)和大理石。要区别这两种石料,正确的操作是________________________________________________。
近期石油价格暴涨,有效地利用现有能源和开发新能源已受到各国的普遍重视。
(1)可用改变汽油组成的办法来改善汽油的燃烧性能,例如加入CH3OC(CH3)3生产“无铅汽油”。CH3OC(CH3)3分子中必存在的原子间的连接形式有_______(填写编号)。

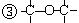

(2)天然气的燃烧产物无毒、热值高、管道输送方便,将成为我国西部开发的重点之一,天然气常和石油伴生,其主要成分是__________。能说明它是正四面体而非正方形平面结构的理由是___________(填写编号)
①其一氯代物不存在同分异构体 ②其二氯代物不存在同分异构体
③碳原子与氢原子之间以共价键结合 ④ 4个碳氢键是完全等价的
(3)1980年我国首次制成一辆燃氢汽车,乘员12人,以每小时50 km的速度行使了40km。为了有效发展民用氢能源,首先必须制得廉价的氢气。下面可供开发又较经济的制氢方法是_______________(填写编号)。
①电解水 ②锌与稀硫酸反应 ③ 光解海水
制得氢气后还需要解决的问题是_________________________(写出其中一个)。
氮化硅是一种超硬物质,抗腐蚀能力强,还能抗冷热冲击。工业上可用高纯硅与纯氮气在高温下反应制取。
(1)根据氮化硅的性质,推测其用途是____________(填序号)。
| A.制造永久性模具 |
| B.制汽轮机叶片 |
| C.制石英玻璃 |
| D.制造柴油机 |
(2)根据氮和硅在周期表中的位置,写出氮化硅的化学式:____________。
(3)氮化硅可被氢氟酸腐蚀,生成四氟化硅和氨。试写出该反应的化学方程式:__________________________________________________。
玻璃钢可由酚醛树脂和玻璃纤维制成。
(1)酚醛树脂由酚醛和甲醛缩聚而成,反应有大量热放出,为防止温度过高,应向有苯酚的反应釜加入甲醛,且反应釜应装有装置。
(2)玻璃纤维由玻璃拉丝得到。普通玻璃由石英砂、和石灰石(或长石)高温熔融而成,主要反应的化学方程式为。
(3)玻璃钢中玻璃纤维的作用是。玻璃钢具有等优异性能(写出两点即可)
(4)下列处理废旧热固性酚醛塑料的做法合理的是
a.深埋
b.粉碎后用作树脂填料
c.用作燃料
d.用有机溶剂将其溶解,回收树脂
A为药用有机物,从A出发可发生图3-1所示的一系列反应。已知A在一定条件下能跟醇发生酯化反应,A分子中苯环上的两个取代基连在相邻的碳原子上;D不能跟NaHCO3溶液反应,但能跟NaOH溶液反应。
图3-1
试完成:
(1)A转化为B、C时,涉及到的反应类型有____________、____________。
(2)E的两种同分异构体Q、R都能在一定条件下发生银镜反应,R能跟金属钠反应放出氢气,而Q不能。Q、R的结构简式分别为:Q____________,R____________。
(3)气体X的化学式为____________,D的结构简式为____________。
(4)A在加热条件下与NaOH溶液反应的化学方程式为:________________________。
黄色固体聚合硫酸铁(SPFS)是一种重要的无机高分子絮凝剂,极易溶于水,作为工业和生活污水处理等领域具有重要的应用。SPFS可表示成Fex(OH)y(SO4)z·nH2O。工业上常用的一种制备流程为:
在SPFS的多个质量指标中,盐基度是重要的质量指标之一,盐基度定义为:
盐基度=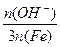 × 100% 。式中n(OH-)、n(Fe)分别表示固体聚合硫酸铁中OH-和Fe元素的物质的量。请回答下列问题:
× 100% 。式中n(OH-)、n(Fe)分别表示固体聚合硫酸铁中OH-和Fe元素的物质的量。请回答下列问题:
(1)写出在酸性介质中用NaClO3氧化绿矾(FeSO4·7H2O)的离子方程式 。
(2)取7.51 g某固体聚合硫酸铁溶解于水,向其中加入过量的BaCl2溶液到沉淀完全,经过滤、洗涤、干燥得白色沉淀10.485 g,向上述滤液中加入NH3·H2O,调节溶液pH=6,经过滤、洗涤、干燥得Fe2O3固体2.80 g。试计算该固体聚合硫酸铁的盐基度为 。
(3)计算出该固体聚合硫酸铁样品的化学式(x、y、z、n均取整数)为 。
使用某些有机物材料给环境造成“白色污染”,后果严重。最近研究的一些分解性塑料,有良好的生物适应性和分解性,能自然腐烂分解。如: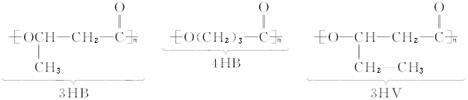
已知3HB的单体叫3羟基丁酸,则:
(1)4HB的名称是_______________,3HV的名称是_______________________。
(2)两分子4HB的单体脱水时,生成的环酯的结构简式为____________________。
近年,科学家通过乙二醇的桥梁作用把阿司匹林连接在高聚物上,制成缓释长效阿司匹林,用于关节炎和冠心病的辅助治疗,缓释长效阿司匹林的结构简式如下: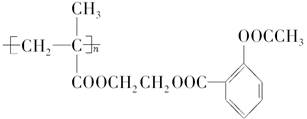
试填写以下空白:
(1)高分子载体结构简式为_________________________
(2)阿司匹林连接在高分子载体上的反应类型是_________________________。
(3)缓释长效阿司匹林在肠胃中变为阿司匹林的化学方程式是______________
在新型有机高分子材料中,有一种感光高分子材料,也称为光敏高分子,是一种在彩电光屏及大规模集成电路的制造中使用的功能高分子材料,其结构简式为: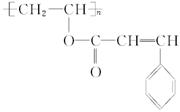
已知它是由两种化合物经酯化后聚合而成的,这两种化合物的结构简式为:__________________________。
KMnO4是一种常用的强氧化剂,工业上可以以软锰矿(主要成分MnO2,另含Al2O3、SiO2杂质)为原料,通过液相法生产。即在碱性条件下用氧气氧化MnO2得到K2MnO4,分离后得到K2MnO4,再用铂板作阳极,铁作阴极电解K2MnO4溶液得到KMnO4,简略生产过程如下所示: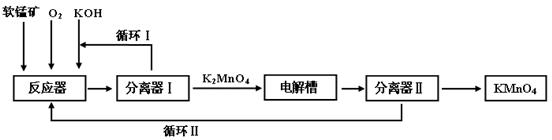
回答下列问题:
(1)写出反应器中反应的方程式
(2)生产过程中最好使用含MnO280%以上的富矿,因为MnO2含量最低的贫矿会导致KOH消耗量偏高,用离子方程式表示KOH消耗偏高的原因 、
。
(3)写出电解槽中阴极和阳极的电极反应方程式
阴极: ;阳极: 。
在电解法中循环Ⅰ、Ⅱ中利用的共同物质是 。
(4)在传统工艺中,得到K2MnO4后,向其中通入CO2制备KMnO4,配平方程式:
K2MnO4+ CO2= KMnO4+ MnO2+ K2CO3
与传统法相比,液相法的优点是:__ _________。
重铬酸钠(Na2Cr2O7)广泛用于合成颜料、媒染剂等,以铬铁矿(主要成分为Cr2O3,还有FeO、Al2O3、SiO2等杂质)为原料制取重铬酸钠的流程图如下: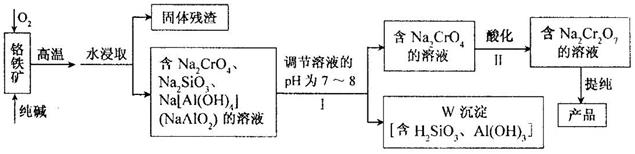
请回答下列问题。
⑴铬铁矿中的Cr2O3与纯碱、O2在高温下反应的化学方程式为 ▲ 。
⑵若Ⅰ中只用一种试剂调节溶液的pH,应选用 ▲ (填标号)。
A.稀硫酸 B.氧化钠固体 C.氢氧化钾溶液
⑶Ⅰ中,调节溶液pH后,如果溶液的pH过小,可能导致W沉淀部分溶解,原因是:
▲ 。(用离子方程式表示)。
⑷Ⅱ中,Na2CrO4转化为Na2Cr2O7的离子反应如下:
2CrO42-(黄色)+2H+ Cr2O72-(橙红色)+H2O
Cr2O72-(橙红色)+H2O
①该反应 ▲ (填“是”或“不是”)氧化还原反应。
②若往Na2Cr2O7溶液(橙红色)中加入足量NaOH固体,溶液 ▲ (填标号)。
A.变黄色 B.颜色不变 C.橙红色变深
③已知:25℃,Ag2CrO4的Ksp=1.12×10-12,Ag2Cr2O7的Ksp=2×10-7。25℃,往Na2Cr2O7溶液中加入AgNO3溶液,最终只生成一种砖红色沉淀,该沉淀的化学式是 ▲ 。
有关钴、镍和铁化合物的性质见下表: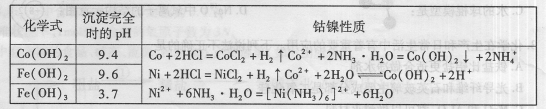
氯化钴可用于化学反应催化剂,油漆催干剂,干湿指示剂,啤酒泡沫稳定剂,陶瓷着色剂,制造隐显墨水等。用金属钴板(含少量Fe、Ni)制备氯化钴的工艺流程如下: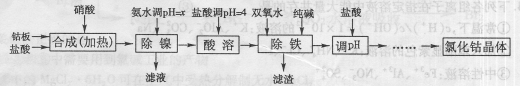
钴与盐酸反应极慢,需加入催化剂硝酸才可能进行实际生产。
(1)“除镍”步骤中,NH3·H2O用量对反应收率的影响,见下表:
从表中可知x= 时,除镍效果最好。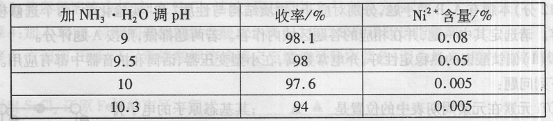
(2)“除镍”步骤必须控制在一定的时间内完成,否则沉淀将有部分Co(OH)3生成,试写出反应的化学方程式 。
(3)“除铁”步骤中加入双氧水发生反应的离子方程式是 .
(4)“除铁”步骤中加入的纯碱作用是 。
(5)在“调pH"步骤中,加盐酸的作用是
(6)已知25℃时,Ksp[Fe(OH)3]=4.0×10-38,则该温度下反应Fe3++3H2O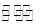 Fe(OH)3+3H+的平衡常数为 。
Fe(OH)3+3H+的平衡常数为 。