CoCl2·6H2O是一种饲料营养强化剂。一种利用水钴矿(主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等)制取CoCl2·6H2O的工艺流程如下:
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
| 沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Co(OH)2 |
Al(OH)3 |
Mn(OH)2 |
| 开始沉淀 |
2.7 |
7.6 |
7.6 |
4.0 |
7.7 |
| 完全沉淀 |
3.7 |
9.6 |
9.2 |
5.2 |
9.8 |
③CoCl2·6H2O熔点为86℃,加热至110~120℃时,失去结晶水生成无水氯化钴。
(1)写出浸出过程中Co2O3发生反应的离子方程式________________________。
(2)写出NaClO3发生反应的主要离子方程式_____________________________;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式_______________。
(3)“加Na2CO3调pH至a”,过滤所得到的沉淀成分为 。
(4)“操作1”中包含3个基本实验操作,它们依次是_________、__________和过滤。制得的CoCl2·6H2O在烘干时需减压烘干的原因是__________________。
(5)萃取剂对金属离子的萃取率与pH的关系如图。向“滤液”中加入萃取剂的目的是_________;其使用的最佳pH范围是________________。
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5 D.5.0~5.5
(6)为测定粗产品中CoCl2·6H2O含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量。通过计算发现粗产品中CoCl2·6H2O的质量分数大于100%,其原因可能是_____________________。(答一条即可)
(选做15分)硫酸铁铵[aFe2(SO4) 3·b(NH4) 2SO4·cH2O]广泛用于城镇生活饮用水、工业循环水的净化处理等。某化工厂以硫酸亚铁(含少量硝酸钙)和硫酸铵为原料,设计了如下工艺流程制取硫酸铁铵。
请回答下列问题:
(1)下列物质中最适合的氧化剂B是 ;
a.NaClO b.H2O2 c.KMnO4 d.K2Cr2O7
反应的离子方程式 。
(2)上述流程中,用足量最适合的氧化剂B氧化之后和加热蒸发之前,需取少量检验Fe2+是否已全部被氧化,能否用酸性的KMnO4溶液? 并说明理由 。(可用文字或方程式说明)
(3)检验硫酸铁铵中NH4+的方法是 。
(4)称取14.00 g所得样品,将其溶于水配制成100 mL溶液,分成两等份,向其中一份中加入足量 NaOH溶液,过滤洗涤得到2.14 g沉淀;向另一份溶液中加入含0.05 mol Ba (NO3)2的溶液,恰好完 全反应。则该硫酸铁铵的化学式为______________________
重铬酸钾是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成份为FeO·Cr2O3,以及SiO2、Al2O3等杂质)为原料生产,实验室模拟工业法用铬铁矿制K2Cr2O7的主要工艺如下: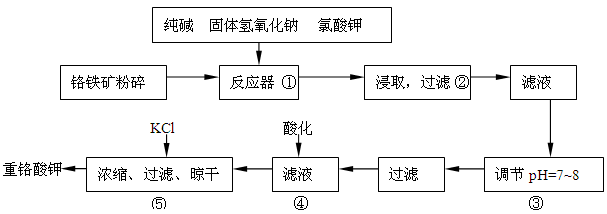
反应器中主要发生的反应为:
Ⅰ.FeO·Cr2O3+NaOH+KClO3→Na2CrO4+Fe2O3+H2O+KCl(未配平)
Ⅱ.Na2CO3+SiO2Δ Na2SiO3+CO2↑
Ⅲ.Al2O3+2NaOHΔ 2NaAlO2+H2O
在步骤③中将溶液pH调节到7~8可以将SiO32-和AlO2-转化为相应的沉淀除去。
(1)在反应Ⅰ中氧化剂是________,若有245g KClO3参加反应,则转移的电子数为_____________。
(2)反应器中生成的Fe2O3又可和Na2CO3反应得到一种摩尔质量为111g/mol的化合物,能强烈水解,在操作②生成沉淀而除去,写出生成该化合物的化学反应方程式_____________________________
___________________________。
(3)操作④目的是将CrO42-转化为Cr2O72-,其现象为__________________________,离子方程式为_______________________________________。
(4)请选用合适的方法进一步提纯粗产品重铬酸钾__________(填字母)
A.重结晶 B.萃取分液 C.蒸馏
(5)分析产品中K2Cr2O7的纯度是利用硫酸酸化的K2Cr2O7将KI氧化成I2,然后利用相关物质测出I2的量从而获得K2Cr2O7的量,写出酸化的K2Cr2O7与KI反应的化学方程式________________________。
[化学—选修(二)化学与技术]常见锌锰干电池因含有汞、酸或碱等,废弃后进入环境将造成严重危害。某化学兴趣小组拟采用如下处理方法回收废电池中的各种资源。
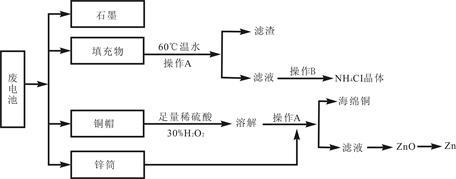
(1)填充物用60℃温水溶解,目的是 。
(2)操作A的名称为 。
(3)铜帽溶解时加入H2O2的目的是 (用化学方程式表示)。铜帽溶解完全后,可采用_________方法除去溶液中过量的H2O2。
(4)碱性锌锰干电池的电解质为KOH,总反应为Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2,其负极的电极反应式为 。
(5)滤渣的主要成分为含锰混合物,向含锰混合物中加入一定量的稀硫酸、稀草酸,并不断搅拌至无气泡为止。主要反应为 2MnO(OH)+MnO2+2H2C2O4+3H2SO4=3MnSO4+4CO2↑+6H2O。
①当1 mol MnO2参加反应时,共有 mol电子发生转移。
②MnO(OH)与浓盐酸在加热条件下也可发生反应,试写出该应的化学方程式: 。
(6)锌锰干电池所含的汞可用KMnO4溶液吸收。在不同pH下,KMnO4溶液对Hg的吸收率及主要产物如下图所示:

根据上图可知:
①pH对Hg吸收率的影响规律是随pH升高,汞的吸收率 。
②在强酸性环境下Hg的吸收率高的原因可能是KMnO4在酸性条件下 强。
 新型锂离子电池在新能源的开发中占有重要地位。可用作节能环保电动汽车的动力电池。磷酸亚铁锂(LiFePO4)是新型锂离子电池的首选电极材料,它的制备方法如下:
新型锂离子电池在新能源的开发中占有重要地位。可用作节能环保电动汽车的动力电池。磷酸亚铁锂(LiFePO4)是新型锂离子电池的首选电极材料,它的制备方法如下: 方法一:将碳酸锂、乙酸亚铁[(CH3COO)
方法一:将碳酸锂、乙酸亚铁[(CH3COO) Fe]、磷酸二氢铵按一定比例混合、充分研磨后,在800℃左右、惰性气体氛围中煅烧制得晶态磷酸亚铁锂,同时生成的乙酸及其它产物均以气体逸出。
Fe]、磷酸二氢铵按一定比例混合、充分研磨后,在800℃左右、惰性气体氛围中煅烧制得晶态磷酸亚铁锂,同时生成的乙酸及其它产物均以气体逸出。 方法二:将一定浓度的磷酸二氢铵、氯化锂混合溶液作为电解液,以铁棒为阳极,石墨为阴极,电解析出磷酸亚铁锂沉淀。沉淀经过滤、洗涤、干燥,在800℃左右、惰性气体氛围中煅烧制得晶态磷酸亚铁锂。
方法二:将一定浓度的磷酸二氢铵、氯化锂混合溶液作为电解液,以铁棒为阳极,石墨为阴极,电解析出磷酸亚铁锂沉淀。沉淀经过滤、洗涤、干燥,在800℃左右、惰性气体氛围中煅烧制得晶态磷酸亚铁锂。 在锂离子电池中,需要一种有机聚合物作为正负极之间锂离子迁移的介质,该有机聚合物的单体之一(用M表示)的结构简式如下:
在锂离子电池中,需要一种有机聚合物作为正负极之间锂离子迁移的介质,该有机聚合物的单体之一(用M表示)的结构简式如下:

 请回答下列问题:
请回答下列问题: (1)上述两种方法制备磷酸亚铁锂的过程都必须在惰性气体氛围中进行。其原因是
(1)上述两种方法制备磷酸亚铁锂的过程都必须在惰性气体氛围中进行。其原因是 。
。 (2)在方法一所发生的反应中, 除生成磷酸亚铁锂、乙酸外,还有 、
(2)在方法一所发生的反应中, 除生成磷酸亚铁锂、乙酸外,还有 、 、 (填化学式)生成。
、 (填化学式)生成。 (3)在方法二中,阳极生成磷酸亚铁锂的电极反应式为
(3)在方法二中,阳极生成磷酸亚铁锂的电极反应式为 。
。 (4)写出M与足量氢氧化钠溶液反应的化学方程式:
(4)写出M与足量氢氧化钠溶液反应的化学方程式: 。
。 (5)已知该锂离子电池在充电过程中,阳极的磷酸亚铁锂生成磷酸铁,则该电池放电时正极的电极反应式为
(5)已知该锂离子电池在充电过程中,阳极的磷酸亚铁锂生成磷酸铁,则该电池放电时正极的电极反应式为 。
。
锌锰干电池所含的汞、酸或碱等在废弃后进入环境中将造成严重危害。对废旧电池进行资源化处理显得非常重要。某化学兴趣小组拟采用如下处理方法回收废电池中的各种资源。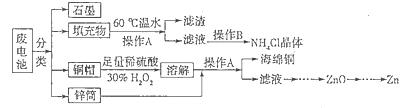
(1)碱性锌锰干电池的电解质为KOH,总反应为Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2,其负极的电极反应式为_________________________________________________________。
(2)填充物用60℃温水溶解,目的是加快溶解速率,但必须控制温度不能太高,其原因是___________。
(3)操作A的名称为_____________ 。
(4)滤渣的主要成分为含锰混合物,向含锰混合物中加入一定量的稀硫酸、稀草酸,并不断搅拌至无气泡为止。其主要反应为2MnO(OH)+MnO2+2H2C2O4+3H2SO4=2MnSO4+4CO2↑+6H2O。
①当1 mol MnO2参加反应时,共有___________mol电子发生转移。
②MnO(OH)与浓盐酸在加热条件下也可发生反应,试写出其反应的化学方程式:________________。
(5)铜帽溶解时加入H2O2的目的是_______________________________(用化学方程式表示)。铜帽溶解完全后,可采用_____________方法除去溶液中过量的H2O2。
(6)锌锰干电池所含的汞可用KMnO4溶液吸收。在不同pH下,KMnO4溶液对Hg的吸收率及主要产物如下图所示: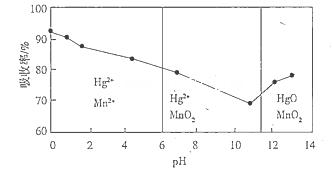
根据上图可知:
①pH对Hg吸收率的影响规律是__________________________________________________.
②在强酸性环境下Hg的吸收率高的原因可能是_____________________________________.
工业上常用含少量Al2O3的钒铁矿(FeO·V2O5)碱熔法提取V2O5。简要流程如下:
已知:①焙烧时Al2O3和V2O5都能与纯碱反应,生成相对应的钠盐,同时放出CO2气体
②常温下物质的溶解度:NaVO3~21.2g/l00g水;HVO3~0.008g/l00g水
请回答:(1)请写出钒铁矿焙烧时,V2O5与纯碱反应化学方程式____ 。
“浸出渣B”的主要成分可能是① ;②_ ___ ;③_ ___;④____ 。(写化学式,可不填满)
(2)生产中,不直接用H2SO4浸泡“烧渣A”获取HVO3的原因是____ 。
(3)“操作①”包括 、洗涤、干燥。如果不洗涤,则产品中可能含有的金属阳离子是 、 。下列装置(部分夹持仪器省去)可用在实验室进行“操作②”的是____ 。(填序号)
(4)NaVO3用于原油的脱硫技术,由V2O5溶于热NaOH溶液中制取,反应的离子方程式为____ 。
以含有Al2O3、Fe2O3等杂质的铬铁矿[主要成份为Fe(CrO2)2]为主要原料生产重铬酸钠晶体( Na2Cr2O7·2H2O)的主要工艺流程如下:
己知:铬铁矿在空气中与纯碱煅烧生成Na2CrO4和一种红棕色固体,同时释放出CO2气体,同时A12O3+Na2CO3 2NaAlO2+CO2↑。请回答:
2NaAlO2+CO2↑。请回答:
(1)在铬铁矿Fe(CrO2)2中,Cr的化合价为____。
(2)滤渣1的成分为________,滤渣2的成分为____。
(3)将滤渣l放入稀硫酸溶解后得溶液W,检验该溶液中金属离子的方法是 。
(4)铬铁矿中的Al2O3杂质在工业上可用来冶炼铝,该化学方程式为
(5)根据有关国家标准,含CrO42-的废水要经化学处理,使其浓度降至5.0×10-7 mo1/L以下才能排放。含CrO42-的废水处理通常有以下两种方法。
①沉淀法:加入可溶性钡盐生成BaCrO4沉淀 ,再加入可溶性硫酸盐处理多余的Ba2+。加入可溶性钡盐后的废水中Ba2+的浓度应不小于 mol/L,后续废水处理方能达到国家排放标准。
,再加入可溶性硫酸盐处理多余的Ba2+。加入可溶性钡盐后的废水中Ba2+的浓度应不小于 mol/L,后续废水处理方能达到国家排放标准。
②还原法: 。写出酸性条件下 CrO42-与绿矾在溶液中反应的离子方程式 。
。写出酸性条件下 CrO42-与绿矾在溶液中反应的离子方程式 。
(6)某高效净水剂是由K2FeO4得到的,工业上以溶液W、次氯酸钾和氢氧化钾为原料制备K2FeO4,该反应的化学方程式是 。
铁及其化合物在日常生活中应用广泛,请根据下列实验回答问题:
(1)钢铁在潮湿的空气中发生吸氧腐蚀的正极反应式为 。
(2)生铁中含有一种铁碳化合物X(Fe3C),X在足量的空气中高温煅烧,生成有磁性氧化物Y,Y可溶于过量盐酸,形成黄绿色的溶液,写出Y与盐酸反应的化学方程式 。
(3)某炼铁废渣中含有大量CuS及少量铁的化合物,工业上以该废渣为原料生产CuCl2·H2O的工艺流程如下:
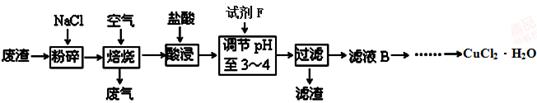
已知:Fe(OH)2、Fe(OH)3、Cu(OH)2沉淀完全时的pH值分别为9.7、3.3、6.4。
试回答下列问题:
①试剂F应选用 (填编号)。
A.Cl2 B.NaClO C.HNO3 D.浓硫酸
理由是 。
②为了获得晶体,对滤液B进行的操作是蒸发浓缩,趁热过滤,滤液经冷却结晶,过滤得到产品。分析有关物质的溶解度曲线(如图),“趁热过滤”得到的固体是 。

CoCl2·6H2O是一种饲料营养强化剂。一种利用水钴矿(主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等)制取CoCl2·6H2O的工艺流程如下:

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的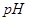 见下表:(金属离子浓度为:0.01mol/L)
见下表:(金属离子浓度为:0.01mol/L)
| 沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Co(OH)2 |
Al(OH)3 |
Mn(OH)2 |
| 开始沉淀 |
2.7 |
7.6 |
7.6 |
4.0 |
7.7 |
| 完全沉淀 |
3.7 |
9.6 |
9.2 |
5.2 |
9.8 |
③CoCl2·6H2O熔点为86℃,加热至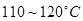 时,失去结晶生成无水氯化钴。
时,失去结晶生成无水氯化钴。
(1)写出浸出过程中Co2O3发生反应的离子方程式 。
(2)写出NaClO3发生反应的主要离子方程式 ;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式 。
(3)“加Na2CO3调pH至5.2”,过滤所得到的沉淀成分为 ,加入萃取剂的目的是 。
(4)制得的CoCl2·6H2O在烘干时需减压烘干的原因是 。
(5)为测定粗产品中CoCl2·6H2O含量,称取一定质量的粗产品溶于水,加入足量HNO3酸化的AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量。通过计算发现粗产品中CoCl2·6H2O的质量分数大于100%,其原因可能是 。(答一条即可)
【化学——选修2:化学与技术】
锂电池在人们生产生活中的应用十分广泛,其消耗量巨大,对不可再生的金属资源造成了相当大的消耗。因此,锂离子的电池回收具有重要的意义。其中需要重点回收的是正极材料,其主要成分为钴酸锂( LiCoO2)、导电乙炔黑(一种炭黑)、铝箔以及有机粘接剂:
某工厂的回收工艺流程如下:
(1)上述工艺回收到的产物有 。
(2)废旧电池可能由于放电不完全而残留有原子态的锂,为了安全对拆解环境的要求是 。
(3)滤液用稀硫酸调pH时反应的离子方程式为 。
(4)酸浸时反应的化学方程式为 。如果用盐酸代替H2SO4和H2O2混合液中的H2SO4也能达到溶解的目的,但不利之处是 。
(5)生成Li2CO3的化学反应方程式为 。已知Li2CO3在水中的溶解度随着温度升高而减小,最后一步过滤时应该 。
钛有强度高和质地轻的优点,广泛应用于飞机制造业等。工业上利用钛铁矿,其主要成分为钛酸亚铁(FeTiO3)制备钛金属,工业流程如下: 已知:Ti与TiO2化学性质稳定,不溶于稀硫酸、稀盐酸等。
(1)请写出FeTiO3与稀盐酸反应的离子方程式: 。
(2)请写出“熔融氧化”的化学方程式: 。
(3)电解氯化镁的阴极反应式为: ,可循环利用的物质为: (填化学式)。
(4)热还原法中能否改用钠代替镁作还原剂: (填“能”或“不能”);原因为: 。
(5)用此方法制备得到的Ti金属常混有MgCl2和Mg,除杂试剂是 (填化学式)。
二氧化铈(CeO2)是一种重要的稀土氧化物。平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2以及其他少量可溶于稀酸的物质)。某课题组以此粉末为原料回收铈,设计实验流程如下:
(1)洗涤滤渣A的目的是为了除去____________(填离子符号),检验该离子是否洗净的方法是_________________________________________________________。
(2)第②步反应的离子方程式是______________________________________,滤渣B的主要成分是___________________。
(3)萃取是分离稀土元素的常用方法,已知化合物TBP作为萃取剂能将铈离子从水溶液中萃取出来,TBP______________(填“能”或“不能”)与水互溶。实验室进行萃取操作时用到的主要玻璃仪器有_______________、烧杯、玻璃棒、量筒等。
(4)取上述流程中得到的Ce(OH)4产品0.536 g,加硫酸溶解后,用0.100 0 mol·L-1 FeSO4标准溶液滴定至终点时(铈被还原为Ce3+),消耗25.00 mL标准溶液。该产品中Ce(OH)4的质量分数为___________(结果保留两位有效数字)。
钛及其化合物大量应用于航空、造船、电子、化学、医疗器械、电讯器材等各个领域。由钛铁矿(FeTiO3)提取金属钛(海绵钛)的主要工艺流程如下(部分产物省略):
(1)氯化的过程是将二氧化钛、碳粉混合,在高温条件下通入氯气制得TiCl4和一种可燃性气体,该反应的化学方程式为 ;TiCl4在室温下为无色液体,氯化后提纯四氯化钛的方法是过滤、____ 。
(2)还原过程是用过量的镁在高温条件下与TiCl4反应制得海绵钛。写出此反应的化学方程式 。
(3)还原过程必须在1070 K的温度下进行,你认为还应该控制的反应条件是 。
(4)常温下,钛不与水、稀盐酸、稀H2SO4或稀HNO3作用,但易溶于氢氟酸,推测其原因是 。
| A.氢氟酸的酸性比其他酸强 |
| B.氢氟酸的氧化性比其他酸强 |
| C.氢氟酸的还原性比其他酸强 |
| D.钛离子易与氟离子形成可溶性难电离物质 |
(5)上述工艺中,得到的海绵钛中可能含有金属镁,常温下除去该杂质应选用的试剂是稀盐酸或稀硫酸,不选择稀硝酸的原因是__ __;若杂质只有金属镁的某海绵钛样品,去除杂质后质量减少十分之一,则该样品中n(Ti):n(Mg)= 。
炼锌厂产生的工业废渣——锌渣(除了含Zn外,还含有Fe、Al、Cd和SiO2等杂质),利用锌渣制取并回收ZnSO4·7H2O和金属镉(Cd)是一个有益的尝试,其流程如下: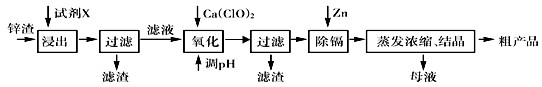
已知:Fe3+、Al3+、Zn2+、Cd2+、Fe2+以氢氧化物完全沉淀时的pH分别为:3.2,4.7,6.5,9.4,9.7。试回答下列问题:
(1)浸出时用到的试剂X为 , 写出溶解过程中加快浸出速率和提高浸出率的两点措施:_______________________________,______________________________。
(2)写出加入Ca(ClO)2反应的离子方程式 。
(3)调节pH过程可以选用 (填“ZnO”或“NaOH”);本流程的pH调节一般调至5,其目的是 。
(4)写出过滤后加入过量的锌粉反应的离子方程式 。
(5)在蒸发浓缩操作时,要采取实验措施是: 。