废旧硬质合金刀具中含碳化钨(WC)、金属钴(Co)及少量杂质铁,利用电解法可回收WC和Co。工艺流程简图如下:
(1)电解时废旧刀具做阳极,不锈钢做阴极,HCl溶液为电解液。阴极主要的电极反应式为________________________________________________________________________。
(2)净化步骤所得滤饼的主要成分是________。回收的洗涤液代替水配制电解液,目的是回收利用其中的________。
(3)溶液Ⅰ的主要成分是________。洗涤CoC2O4不充分对最终产品纯度并无明显影响,但焙烧时会造成环境污染,原因是____________________________________________。
(4)将Co2O3还原成Co粉的化学反应方程式为____________________。
工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁[Fe(OH)SO4]的工艺流程如下:

已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Al(OH)3 |
| 开始沉淀 |
2.3 |
7.5 |
3.4 |
| 完全沉淀 |
3.2 |
9.7 |
4.4 |
回答下列问题:
(1)加入少量NaHCO3的目的是 ,该工艺中“搅拌”的作用是 。
(2)反应Ⅱ中的离子方程式为 ,在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,O2的作用是 。(用化学方程式表示)
(3)生产中碱式硫酸铁溶液蒸发时需要在常温减压条件下的原因是 。
(4)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁。根据我国质量标准,产品中不得含有Fe2+及NO3-。为检验所得产品中是否含有Fe2+,应使用的试剂为 。(填写字母)
A.氯水 B.KSCN溶液 C.NaOH溶液 D.酸性KMnO4溶液
下图是传统的工业生产金属铝的基本流程图。结合铝生产的流程图回答下列问题: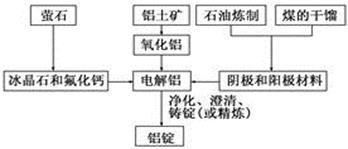
(1)工业冶炼金属铝用的是铝土矿,铝土矿的主要成分是________(填化学式)。石油炼制和煤的干馏产品__________(填物质名称)作电解铝的阴极和阳极材料。
(2)在金属铝的冶炼中加入冰晶石和氟化钙的目的是________
(3)在冶炼过程中,阳极材料需要定期进行更换,原因是氧化铝溶解并和部分冰晶石发生反应生成Al2OF62-,写出该反应的离子方程式________________。若电解的总反应为2Al2O3+3C 3CO2+4Al,则阳极的电极反应式为_______________。
3CO2+4Al,则阳极的电极反应式为_______________。
(4)冰晶石能在碱性溶液中分解,写出冰晶石与足量NaOH溶液反应生成两种钠盐的化学方程式______________。
(5)已知生产1mol铝消耗的电能为1.8x106J,9g铝制饮料罐可回收能量为0.2kJ,则铝制饮料罐的热回收效率η=_____________。(热回收效率= 回收能量/生产耗能x100%)
将磷肥生产中形成的副产物石膏(CaSO4·2H2O)转化为硫酸钾肥料和氯化钙水合物储热材料,无论从经济效益、资源综合利用还是从环境保护角度看都具有重要意义。以下是石膏转化为硫酸钾和氯化钙的工艺流程示意图。
(1)本工艺中所用的原料除CaSO4·2H2O、KCl外,还需要 等原料
(2)写出石膏悬浊液中加入碳酸铵溶液后发生反应的离子方程式:
(3)过滤Ⅰ操作所得固体中,除CaCO3外还含有 (填化学式)等物质,该固体可用作生产水泥的原料。
(4)过滤Ⅰ操作所得滤液是(NH4)2SO4溶液。检验滤液中含有CO32-的方法是:____________ 。
(5)已知不同温度下K2SO4在100g水中达到饱和时溶解的量如下表:
| 温度(℃) |
0 |
20 |
60 |
| K2SO4溶解的量(g) |
7.4 |
11.1 |
18.2 |
60℃时K2SO4的饱和溶液591g冷却到0℃,可析出K2SO4晶体 g
(6)氯化钙结晶水合物(CaCl2·6H2O)是目前常用的无机储热材料,选择的依据是
a、熔点较低(29℃熔化) b、能导电 c、能制冷 d、无毒
(7)上述工艺流程中体现绿色化学理念的是:
随着能源问题的进一步突出,利用热化学循环制氢的研究受到许多发达国家的青睐。最近的研究发现,复合氧化物铁酸锰(MnFe2O4)也可以用于热化学循环分解水制氢,MnFe2O4的制备流程如下:
(1)原料Fe(NO3)n中n=________,投入原料Fe(NO3)n和Mn(NO3)2的物质的量之比应为________。
(2)步骤二中“连续搅拌”的目的是__________________________________________
步骤三中洗涤干净的标准是________________________________________________
(3)利用MnFe2O4热化学循环制氢的反应可表示为:
MnFe2O4 MnFe2O4-x+O2↑;
MnFe2O4-x+O2↑;
MnFe2O4-x+xH2O MnFe2O4+xH2↑
MnFe2O4+xH2↑
请认真分析上述两个反应并回答下列问题:
①若MnFe2O4-x中x=0.8,则MnFe2O4-x中Fe2+占全部铁元素的百分率为________。
②该热化学循环制氢法的优点有_____________________、________________________ (答两点即可)。
该热化学循环法制氢尚有不足之处,进一步改进的研究方向是___________________________________________________________。
(10 分)硫铁矿烧渣是硫铁矿生产硫酸过程中产生的工业废渣(主要含Fe2O3及少量SiO2、A12O3等杂质)。用该烧渣制取药用辅料——红氧化铁的工艺流程如下:
(1)在“还原焙烧”中产生的有毒气体可能有______________。
(2)“酸浸”时间一般不超过20 min,若在空气中酸浸时间过长,溶液中Fe2+含量将下降,其原因是____________________(用离子方程式表示)。
(3)“中和合成”的目的是将溶液中Fe2+转变为碳酸亚铁沉淀,则操作B 是_______。
(4)煅烧A 的反应方程式是___________________________________。
(5)a g 烧渣经过上述工艺可得红氧化铁b g。药典标准规定,制得的红氧化铁中含氧化铁不得少于98.0%,则所选用的烧渣中铁的质量分数应不低于_____________(用含a、b 的表达式表示)。
上利用硫铁矿烧渣(主要成分为Fe2O3、FeO、SiO2等)为原料制备高档颜料铁红(Fe2O3),具体生产流程如下:
试回答下列问题:
(1)滤液X中含有的金属阳离子是______________(填离子符号)。
(2)步骤Ⅲ中可选用________调节溶液的pH(填字母)。
| A.稀硫酸 | B.氨水 | C.氢氧化钠溶液 | D.高锰酸钾溶液 |
(3)步骤Ⅳ中,FeCO3沉淀完全后,溶液中含有少量Fe2+,检验Fe2+的方法是________________________________。
(4)步骤Ⅳ的反应温度一般需控制在35℃以下,其目的是_____________________________________________。
(5)在空气中煅烧FeCO3生成产品氧化铁的化学方程式为______________________________。
用霞石岩(主要成分为Na2O、K2O、Al2O3、SiO2)制碳酸钠、碳酸钾和氧化铝的工艺流程如下:已知:NaHCO3溶液的pH约为8~9,Na2CO3溶液的pH约为11~12。

溶解过滤工序产生的滤液中含钠、钾和铝的可溶性盐类,钙和硅等其他杂质在滤渣霞石泥中。部分物质的溶解度如上图,根据题意回答下列问题:
(1)固体M的化学式是________,X物质是________。
(2)实验室进行煅烧操作时盛放固体物质的实验仪器是________,滤液W中主要含有的离子有________。
(3)碳酸化Ⅰ中发生主要反应的离子方程式是____________。
(4)操作Ⅰ是________(填写名称),操作Ⅱ是________(选填编号)。
a.趁热过滤 b.冷却过滤 c.蒸馏 d.灼烧
(5)碳酸化Ⅱ调整pH=8的目的是______,产品K2CO3中最可能含有的杂质是__________(写化学式)。
近年来,高锰酸钾在饮用水和工业污水处理领域的消费需求增长较快。实验室可用二氧化锰为主要原料制备高锰酸钾。其部分流程如下:
(1)第①步中采用铁坩埚而不用瓷坩埚的原因是(用化学方程式表示)________________________________________。
(2)KOH、KClO3和MnO2共熔反应生成墨绿色K2MnO4的化学方程式为________________________________________。
(3)第④步通入CO2可以使MnO42—发生反应,生成MnO4—和MnO2。则K2MnO4完全反应时,转化为KMnO4的百分率约为________(精确到0.1%)。
(4)第⑤步趁热过滤的目的是______________________________________。
(5)第⑥步加热浓缩至液面有细小晶体析出时,停止加热,冷却结晶、________、洗涤、干燥。干燥过程中,温度不宜过高,因为____________________________________。
工业利用精炼镁渣(含有MgO、KCl、MgCl2、BaCl2、CaCl2、FeCl3等杂质)回收MgCl2的工业流程如下: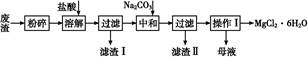
已知:25 ℃时有关物质的溶度积如下:
| 物质 |
CaCO3 |
MgCO3 |
BaCO3 |
Mg(OH)2 |
Fe(OH)3 |
| Ksp |
4.96×10-9 |
6.82×10-6 |
5.1×10-9 |
5.61×10-12 |
2.64×10-38 |
回答下列问题:
(1)写出溶解时的离子方程式 。
(2)溶解时温度不能太高,也不宜太低,要求控制在35 ℃左右,其理由是 。
(3)操作Ⅰ包含多个操作,分别为 ,过滤,洗涤,烘干。烘干时需要减压烘干,原因是 。
(4)为减少Na2CO3的用量和提高产品质量,在中和工序(中和后溶液接近中性)结束前要检验溶液中是否存在 离子,选择检验该离子的原因是 。
(5)母液的主要成分 。
实验室用辉铜矿(主要成分为Cu2S,含少量Fe2O3、SiO2等杂质)制备碱式碳酸铜的主要实验流程如下。
(1)滤渣Ⅰ的成分为MnO2、单质S和 (写化学式);硫酸浸取时,Cu2S被MnO2氧化的化学方程式为 。
(2)浸取时,Fe2O3溶于硫酸的离子方程式为 ;研究发现若先除铁再浸取,浸取速率明显变慢,其可能原因是 。
(3)“赶氨”时,最适宜的操作方法是 。
(4)滤液Ⅱ经蒸发结晶得到的盐主要是 (写化学式)。
四氯化钛(TiCl4)是制取航天航空工业材料——钛合金的重要原料。由钛铁矿(主要成分是FeTiO3)制备TiCl4等产品的一种工艺流程示意图如下:
(1)往①中加入铁屑至浸出液显紫色,此时溶液仍呈强酸性。该过程中有如下反应发生:
Fe+2Fe3+=3Fe2+
2TiO2+(无色)+Fe+4H+=2Ti3+(紫色)+Fe2++2H2O
Ti3+(紫色)+Fe3++H2O=TiO2+(无色)+Fe2++2H+
加入铁屑的作用是 。
(2)在②→ ③工艺过程中需要控制条件以形成TiO2·nH2O溶胶,该溶胶的分散质颗粒直径大小在 范围。
(3)若把③中制得的固体TiO2·nH2O用酸清洗除去其中的杂质,还可制得钛白粉。已知25℃时,Ksp[Fe(OH)3]=2.79×10-39,该温度下反应Fe(OH)3+3H+  Fe3++3H2O的平衡常数K= 。
Fe3++3H2O的平衡常数K= 。
(4)已知:TiO2(s)+2Cl2(g)=TiCl4(l)+O2(g)
ΔH="+140" kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH=-221 kJ·mol-1
写出④中TiO2和焦炭、氯气反应生成液态TiCl4和CO气体的热化学方程式: 。
(5)上述工艺具有成本低、可用低品位矿物为原料等优点。依据绿色化学理念,该工艺流程中存在的不足之处是 (只要求写出一项 )。
(6)依据下表信息,要精制含少量SiCl4杂质的TiCl4,可采用_______方法。
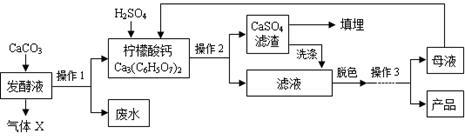
(16分)柠檬酸(C6H8O7)是一种工业原料,广泛应用于食品、医药等行业。下图是两种不同方法制备一水柠檬酸晶体(C6H8O7·H2O)的工艺流程图。回答相关问题:
【资料卡片】:
①柠檬酸水溶液显酸性,柠檬酸钙不溶于水;
②工业生产柠檬酸,原料预处理后,得到的发酵液中
含有柠檬酸及其他可溶性杂质;
③一水柠檬酸在不同温度下的溶解度如下表:
| 温度/℃ |
0 |
10 |
20 |
30 |
40 |
… |
| 溶解度/g |
96 |
118 |
146 |
183 |
216 |
… |
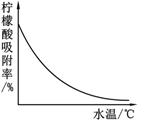
④某种专用树脂对柠檬酸的吸附率和水温的关系如图:
【钙盐法制备】
(1)气体X是 (填化学式),实验室检验该气体的化学方程式为 ;
(2)操作1、2的名称是 ;
(3)操作3的目的是得到一水柠檬酸晶体,操作顺序是b → → a;(填序号)
a.过滤 b.加热浓缩 c.冷却结晶 d.蒸发结晶
(4)工业生产中,可加入 (填序号)进行脱色处理;
A.活性炭 B.明矾 C.肥皂水
(5)洗涤CaSO4滤渣的目的是 ;
(6)母液可以循环,其中一定含有的溶质是 ;
(12 分)钛铁矿的主要成分为FeTiO3(可表示为FeO·TiO2),含有少量MgO、CaO、SiO2等杂质。利用钛铁矿制备锂离子电池电极材料(钛酸锂Li4Ti5O12和磷酸亚铁锂LiFePO4)的工业流程如下图所示:
已知:FeTiO3与盐酸反应的离子方程式为:FeTiO3+4H++4Cl-===Fe2++TiOCl42-+2H2O。
(1)若在实验室中煅烧固体混合物,会用到多种硅酸盐质的仪器,除玻璃棒、酒精灯、泥三角外,还有 (填仪器名称)。流程中多次涉及沉淀,则洗涤沉淀的方法是 。
(2)生产中利用滤渣A制备半导体的反应是 。
(3)滤液B中TiOCl42-转化生成TiO2的离子方程式是 。
(4)反应②中固体TiO2转化成(NH4)2Ti5O15溶液时,Ti元素的浸出率与反应温度有关,反应温度过高时,Ti元素浸出率会下降,其原因是 。
(5)写出由滤液D生成FePO4的离子方程式 。由滤液D制备LiFePO4的过程中,所需双氧水与H2C2O4的物质的量比是 。
(共12分)一种含铝、锂、钴的新型电子材料,生产中产生的废料数量可观,废料中的铝以金属铝箔的形式存在;钴以Co2O3·CoO的形式存在,吸附在铝箔的单面或双面;锂混杂于其中。
从废料中回收氧化钴(CoO)的工艺流程如下:
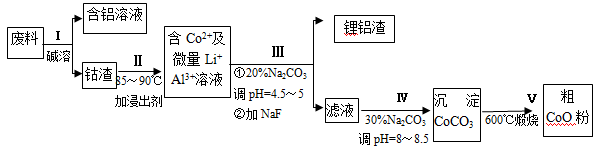
(1)过程I中采用NaOH溶液溶出废料中的Al,反应的离子方程式为 。
(2)过程II中加入稀H2SO4酸化后,再加入Na2S2O3溶液浸出钴。则浸出钴的化学反应方程式为(产物中只有一种酸根) 。在实验室模拟工业生产时,也可用盐酸浸出钴,但实际工业生产中不用盐酸,请从反应原理分析不用盐酸浸出钴的主要原因_______________。
(3)过程Ⅲ得到锂铝渣的主要成分是LiF和Al(OH)3,碳酸钠溶液在产生Al(OH)3时起重要作用,请写出该反应的离子方程式____________________。
(4)碳酸钠溶液在过程III和IV中所起作用有所不同,请写出在过程IV中起的作用是__________。
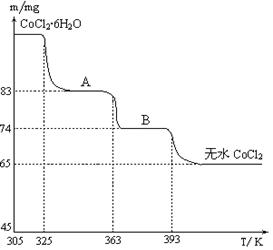
(5)CoO溶于盐酸可得粉红色的CoCl2溶液。CoCl2含结晶水数目不同而呈现不同颜色,利用蓝色的无水CoCl2吸水变色这一性质可制成变色水泥和显隐墨水。下图是粉红色的CoCl2·6H2O晶体受热分解时,剩余固体质量随温度变化的曲线,A物质的化学式是______。