钼(Mo)是一种过渡金属元素,通常用作合金及不镑钢的添加剂,这种元素可增强合金的强度、硬度、可焊性及韧性,还可增强其耐高温及耐腐蚀性能。如图是化工生产中制备 金属钼的主要流程图,已知钼酸难溶于水。
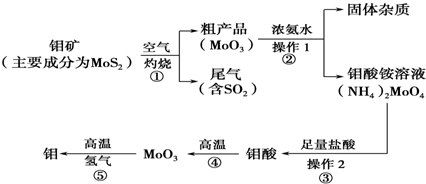
(1)写出反应①的化学方程式: 。
(2)写出反应②的化学方程式: 。
(3)反应①的尾气可以用碳酸钠溶液吸收。已知:根据表中提供的数据可知,在溶液中不能大量共存的微粒是______________;
| A.HCO3-、HSO3- | B.HCO3-、SO32- | C.HCO3-、H2S03 | D.HSO3- CO32- |
向过量碳酸钠溶液中通人少量二氧化硫,写出反应的离子方程式: 。
(4)如果在实验室模拟操作1和操作2,则需要使用的主要玻璃仪器有 。
(5)工业上制备还原性气体CO和H2的反应原理为C02+CH4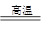 2CO + 2H2,CH4 + H2
2CO + 2H2,CH4 + H2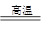 CO + 3H2,含甲烷体积分数为80%的10L(标准状况)天然气与足量二氧化碳和水蒸气的混合物在高温下反应,甲烷转化率为90%,用产生的还原性气体(CO和H2)还原Mo03制钼,理论上能生产钼的质量为g(小数点后保留1位,钼的相对原子质量为96)。
CO + 3H2,含甲烷体积分数为80%的10L(标准状况)天然气与足量二氧化碳和水蒸气的混合物在高温下反应,甲烷转化率为90%,用产生的还原性气体(CO和H2)还原Mo03制钼,理论上能生产钼的质量为g(小数点后保留1位,钼的相对原子质量为96)。
氯化亚铜(CuCl)常用作有机合成工业中的催化剂,是一种白色粉末;微溶于水、不溶于乙醇及稀硫酸;在空气中迅速被氧化成绿色;见光则分解,变成褐色。下图是工业上以制作印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl-)生产CuCl的流程:
根据以上信息回答下列问题:
(1)写出生产过程中所加试剂:X__________________,Y________________。
(2)生产中为了提高CuCl产品的质量,采用抽滤法快速过滤,析出的CuCl晶体不用水而用无水乙醇洗涤的目的是________________;生产过程中调节溶液的pH不能过大的原因是________________。
(3)写出产生CuCl的化学方程式:______________________。
(4)在CuCl的生成过程中除环境问题、安全问题外,还应该注意的关键问题是_____________。
分工业上利用锌焙砂(主要含ZnO、ZnFe2O4,还含有少量CaO、FeO、CuO、NiO等氧化物)制取金属锌的流程如图所示。回答下列问题:
(1)酸浸时ZnFe2O4会生成两种盐,该反应的化学方程式为___________。
(2)净化Ⅰ操作分为两步:第一步是将溶液中少量的Fe2+氧化;第二步是控制溶液pH,使Fe3+转化为Fe(OH)3沉淀。
①写出酸性条件下H2O2与Fe2+反应的离子方程式:___________。
②25 ℃时,pH=3的溶液中,c(Fe3+)=___________mol·L-1(已知25 ℃,Ksp[Fe( OH)3]=4.0×10-38)。
③净化Ⅰ生成的沉淀中还含有溶液中的悬浮杂质,溶液中的悬浮杂质被共同沉淀的原因是_______________。
(3)若没有净化Ⅱ操作,则对锌的制备带来的影响是_________________。
(4)本流程中可以循环利用的物质除锌外还有________________。
一种含铝、锂、钴的新型电子材料,生产中产生的废料数量可观,废料中的铝以金属铝箔的形式存在;钴以Co2O3·CoO的形式存在,吸附在铝箔的单面或双面;锂混杂于其中。从废料中回收氧化钴(CoO)的工艺流程如下:
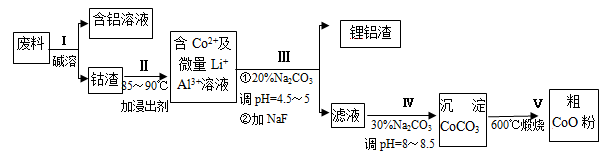
(1)过程I中采用NaOH溶液溶出废料中的Al,反应的离子方程式为 。
(2)过程Ⅱ中加入稀H2SO4酸化后,再加入Na2S2O3溶液浸出钴。则浸出钴的化学反应方程式为(产物中无沉淀且只有一种酸根) 。在实验室模拟工业生产时,也可用盐酸浸出钴,但实际工业生产中不用盐酸,请从反应原理分析不用盐酸浸出钴的主要原因______________ 。
(3)过程Ⅲ得到锂铝渣的主要成分是LiF和Al(OH)3,碳酸钠溶液在产生Al(OH)3时起重要作用,请写出该反应的离子方程式____________________。
(4)碳酸钠溶液在过程Ⅲ和Ⅳ中所起作用有所不同,请写出在过程IV中起的作用是_____________。
(5)在Na2CO3溶液中存在多种粒子,下列各粒子浓度关系正确的是____________(填序号)。
| A.c(Na+) = 2c(CO32-) |
| B.c(Na+) > c(CO32-) > c(HCO3-) |
| C.c(OH-) > c(HCO3-) > c(H+) |
| D.c(OH-) - c(H+) ="=" c(HCO3-) + 2c(H2CO3) |
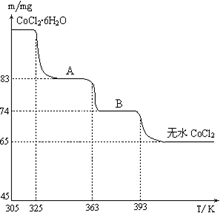
(6)CoO溶于盐酸可得粉红色的CoCl2溶液。CoCl2含结晶水数目不同而呈现不同颜色,利用蓝色的无水CoCl2吸水变色这一性质可制成变色水泥和显隐墨水。下图是粉红色的CoCl2·6H2O晶体受热分解时,剩余固体质量随温度变化的曲线,A物质的化学式是____________。
“烂版液”是制印刷锌板时,用稀硝酸腐蚀锌板后得到的“废液”(含有少量的Cl-、Fe3+),某化学兴趣小组拟用“烂版液”制取Zn(NO3)2·6H2O的过程如下:

已知:Zn(NO3)2·6H2O是一种无色晶体,水溶液呈酸性,Zn(NO3)2能与碱反应,得到的产物具有两性。
生成氢氧化物沉淀的pH
| |
Fe(OH)3 |
Zn(OH)2 |
| 开始沉淀时 |
1.5 |
8.0 |
| 完全沉淀时 |
2.8 |
11.1 |
注: 金属离子的起始浓度为0.1 mol/L
回答下列问题:
(1)“烂版液”中溶质的主要成分是Zn(NO3)2,若稀硝酸腐蚀锌板产生的气体为N2O,写出稀硝酸腐蚀锌板反应的主要化学方程式______________________。
(2)在操作①中保持pH=8的目的是_________________________________。
(3)沉淀Ⅰ的主要成分是___________________________________________。
(4)操作③中调节pH的范围是_______________;目的是_____________________________________。
(12分)聚合硫酸铁铝(PFAS)是一种新型高效水处理剂。利用硫铁矿烧渣(主要成分为Fe3O4、FeO、SiO2等)为铁源、粉煤灰(主要成分为Al2O3、Fe2O3、FeO等)为铝源,制备PFAS的工艺流程如下:
(1)“碱溶”时,Al2O3发生反应的化学方程式为 。
(2)“酸溶Ⅱ”时,Fe3O4发生反应的离子方程式为 。
(3)“滤渣Ⅰ”、“滤渣Ⅱ”在本流程中能加以利用的是 。
(4)“氧化”时应控制温度不超过57℃,其原因是 。
(5)“氧化”时若用酸性高锰酸钾溶液代替,发生反应的离子方程式是 。
(6)酸度对絮凝效果和水质有显著影响。若产品中残留过多,使用时产生的不良后果是
(10分)碳酸铈[Ce2(CO3)3]为白色粉末,难溶于水,主要用作生产铈的中间化合物。它可由氟碳酸铈精矿经如下流程。
(1)氟碳酸铈的化学式为为CeFCO3,该化合物中,Ce的化合价为 。
(2)氧化焙烧生成的铈化合物为二氧化铈(CeO2),其在酸浸时发生反应的离子方程式为 。
(3)试剂X是 。
(4)若试剂X改为氢氧化钠溶液,则反应生成难溶物—一氢氧化铈(Ⅲ),其暴露于空气中时变成紫色,最终变成黄色的氢氧化高铈(Ⅳ)。氢氧化铈在空气中被氧化成氢氧化高铈的化学方程式为 。
(5)取(4)中得到的Ce(OH)4产品(质量分数为97%)1. 00 g,加硫酸溶解后,用0.1000mol·L-1的FeSO4溶液滴定至终点(铈被还原成Ce3+),则需要滴加标准溶液的体积为 mL。
硫酸锌可作为食品锌强化剂的原料。工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量Fe2O3 、FeCO3 、MgO、CaO等,生产工艺流程图如下:

(1)将菱锌矿研磨成粉的目的是___________________。
(2)完成“氧化除铁”步骤中反应的离子方程式:
□Fe(OH)2+ □____+ □_____="=" □Fe(OH)3 + □Cl_
(3)针铁矿(Goethite)是以德国诗人歌德(Goethe)名字命名的,组成元素是Fe、O和H ,化学式式量为89,化学式是_______ 。
(4)根据下表数据,调节“滤液2”的pH时,理论上可选用的最大区间为______ 。
| |
Mg(OH)2 |
Zn(OH)2 |
MgCO3 |
CaCO3 |
| 开始沉淀的pH |
10.4 |
6.4 |
— |
— |
| 沉淀完全的pH |
12.4 |
8.0 |
— |
— |
| 开始溶解的pH |
— |
10.5 |
— |
— |
| Ksp |
5.6×10-12 |
— |
6.8×10-6 |
2.8×10-9 |
(5)工业上从“滤液3”制取MgO过程中,合适的反应物是_________(选填序号)。
a.大理石粉 b.石灰乳 c.纯碱溶液 d.烧碱溶液
(6)“滤液4”之后的操作依次为 ______ 、_______ 、过滤,洗涤,干燥。
(7)分析图中数据,菱锌矿粉中ZnCO3的质量分数不低于 。
碱式氧化镍(NiOOH)可用作镍氢电池的正极材料。以含镍(Ni2+)废液为原料生产NiOOH的一种工艺流程如下:

(1)加入Na2CO3溶液时,确认Ni2+已经完全沉淀的实验方法是 。
(2)已知Ksp[Ni(OH)2]=2×10-15,欲使NiSO4溶液中残留c(Ni2+)≤2×10-5 mol·L-1,调节pH的范围是 。
(3)写出在空气中加热Ni(OH)2制取NiOOH的化学方程式: 。
(4)若加热不充分,制得的NiOOH中会混有Ni(OH)2,其组成可表示为xNiOOH·yNi(OH)2。现称取9.18 g样品溶于稀硫酸,加入100 mL 1.0 mol·L-1 Fe2+标准溶液,搅拌至溶液清亮,定容至200 mL。取出20.00 mL,用0.010 mol·L-1 KMnO4标准溶液滴定,用去KMnO4标准溶液20.00 mL,试通过计算确定x、y的值(写出计算过程)。涉及反应如下(均未配平):
NiOOH+Fe2++H+—Ni2++Fe3++H2O Fe2++MnO4-+H+—Fe3++Mn2++H2O
MnCO3可用作电讯器材元件材料,还可用作瓷釉、颜料及制造锰盐的原料。实验室模拟以MnO2为原料生产MnCO3的工艺流程如下:
已知:MnCO3难溶于水和乙醇,受热易分解。
⑴ 实验室中过滤操作所用到的玻璃仪器有漏斗、烧杯、 。
⑵①检验水洗是否合格的方法是 。
②水洗结束后,用乙醇洗涤的目的是 。
⑶ MnCO3在空气中加热易转化为不同价态的锰的氧化物,其固体残留率随温度的变化如图所示。则300℃时,剩余固体中n(Mn)∶n(O)为 ;图中点D对应固体的成分为 (填化学式)。
高铁酸钾(K2FeO4)是新型多功能水处理剂,碱性条件下性质稳定,其生产过程如下:
请回答下列问题
(1)氯碱工业制Cl2的化学反应方程式 ;
(2)生成“反应液Ⅱ”的离子方程式是 ;(3)使用碱性KClO的原因是 ;
(4)从“反应液II”中分离出K2FeO4后 ,副产品是KCl和 (填化学式),该混合物可用 方法分离提纯(填字母序号);
| A.过滤 | B.分液 | C.蒸馏 | D.重结晶 |
(5)工业生产3.96t K2FeO4,理论上消耗Cl2的物质的量为______mol。
以硫铁矿烧渣(含有氧化铁和少量硫化亚铁、二氧化硅等)为原料制备聚铁{可表示为Fe2(OH)n(SO4)3-n/2,和绿矾(FeSO4.7H2O)具有成本低、反应快、产品质量高等优点。制备流程如下图:
(1)流程图中溶液X为Fe(SO4)3,溶液,据此写出操作①中属于氧化还原反应的离子方程式:____________。
(2)操作②的处理存在弊端,该弊端是_____________。若固体W与KOH溶液昆合加热,其中一个反应的化学方程式为3S+6KOH 2K2S+K2SO3+3H2O,该反应的氧化剂与还原剂质量之比为___________。
2K2S+K2SO3+3H2O,该反应的氧化剂与还原剂质量之比为___________。
(3)操作③需要加入的物质(试剂)是_________,目的是___________________________。
(4)操作⑤是使溶液pH___________(填“增大”或“减小”)。
(5)操作⑥控制温度为70 -80℃的目的是_________________________________________ 。
(6)双氧水在酸性环境(硫酸)中是一种强氧化剂,可以将硫酸亚铁氧化成三价铁,制得Fe2(OH)n(SO4)3-n/2,反应的化学方程式为__________________________________。
【化学—选修2:化学与技术】普通纸张的主要成分是纤维素。在早期的纸张生产中,常采用纸表面涂明矾的工艺,以填补其表面的微孔,防止墨迹扩散,请回答下列问题:
(1)人们发现纸张会发生酸性腐蚀而变脆、破损,严重威胁纸质文物的保存.经分析检验,发现酸性腐蚀主要与造纸中涂敷明矾的工艺有关,其中的化学原理是______________;为了防止纸张的酸性腐蚀,可在纸浆中加入碳酸钙等添加剂,该工艺原理的化学(离子)方程式为______________;
(2)为了保护这些纸质文物,有人建议采取下列措施:
①喷洒碱性溶液,如稀氢氧化钠溶液或氨水等.这样操作产生的主要问题是______________;
②喷洒Zn(C2H5)2.Zn(C2H5)2可以与水反应生成氧化锌和乙烷.用化学(离子)方程式表示该方法生成氧化锌及防止酸性腐蚀的原理______________;
(3)现代造纸工艺常用钛白粉(TiO2)替代明矾.钛白粉的一种工业制法是以钛铁矿(主要成分为FeTiO3)为原料按下列过程进行的,请完成下列化学方程式:
①______ FeTiO3+____ C+___ Cl2 ____ TiCl4+___ FeCl3+____CO
____ TiCl4+___ FeCl3+____CO
②______ TiCl4+____ O2 ____ TiO2+____ Cl2。
____ TiO2+____ Cl2。
钡盐行业生产中排出大量的钡泥,主要含有BaCO3、BaSiO3、BaSO3、Ba(FeO2)2等。某主要生产BaCl2、BaCO3、BaSO4的化工厂利用钡泥制取Ba(NO3)2,其部分工艺流程如下(已知溶液中Fe3+沉淀完全的pH=3.7):
(1)酸溶后溶液中pH=1,Ba(FeO2)2与HNO3的反应化学方程式为 。
(2)酸溶时通常控制反应温度不超过70℃,且不使用浓硝酸,原因是 。
(3)该厂结合本厂实际,选用的X为 (填化学式);中和Ⅰ使溶液中 (填离子符号)的浓度减少(中和Ⅰ引起的溶液体积变化可忽略)。
工业上可以从电解铜的阳极泥中提取很多重要物质,其工艺流程如下: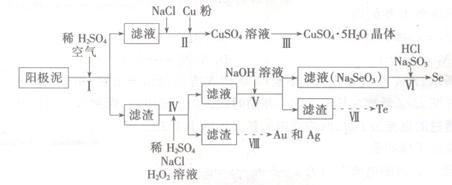
已知:①阳极泥的主要化学成分,如表1所示
表一
| 主要成份 |
Cu Ag Au Se Te |
| 百分含量/% |
23.4 12.1 0.9 6.7 3.1 |
②温度和硫酸浓度对阳极泥中各组分浸出率的影响,如表2所示
表二
| |
固定浸出温度 |
|
|
固定H2SO4浓度 |
| H2SO4浓度 mol/L |
浸出率/% |
|
浸出温度/℃ |
浸出率/% |
| Cu Ag Au Se Te |
|
Cu Ag Au Se Te |
||
| 4 |
95.1 4.67 <0.2 0.83 8.93 |
|
30 |
87.1 4.58 <0.2 0.08 6.83 |
| 3 |
94.5 4.65 <0.2 0.28 6.90 |
|
40 |
94.5 4.65 <0.2 0.28 6.90 |
| 2 |
78.1 2.65 <0.2 0.05 2.85 |
|
50 |
96.1 5.90 <0.2 0.64 8.73 |
(1)步骤I的主要目的为浸出铜,此过程中发生的主要反应的化学方程式为____________分析表2数据,可知步骤I最适合的条件为 。
(2)步骤Ⅱ中,加入Cu粉的目的是除去滤液中含碲的离子,加入NaCl的目的为____。
(3)步骤Ⅲ的操作方法为 。
(4)步骤Ⅳ中,反应温度为75℃。加入H2O2溶液的作用为 ;此过程中H2O2溶液的添加量要远远高于理论值,原因为 。
(5)步骤Ⅵ中所发生反应的化学方程式为 。
(6)步骤Ⅶ中,Te的获得可以通过碱性环境下电解Na2TeO3溶液实现,其阴极的电极反应式为 。
(7)步骤Ⅷ中得到的Au和Ag混合物可以用____进行分离(填选项字母)。
A.稀硝酸 B.浓盐酸 C.浓氢氡化钠溶液 D.王水