【化学工艺与技术】 电镀污泥是指电镀废水处理后产生的污泥和镀槽淤泥,被列入国家危险废物名录,属于第十七类危险废物。 处置电镀污泥回收有价金属,既可以最低限度的降低环境污染,又可以最大限度地节约资源,可谓一举两得。电镀污泥中含有Cr(OH)3、Al(OH)3、Zn(OH)2、CuO、NiO等物质,工业上通过“中温焙烧-钠氧化法”回收Na2Cr2O7等物质。
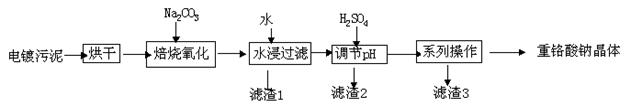
已知:①水浸后溶液中存在Na2CrO4、NaAlO2、Na2ZnO2等物质
②除去滤渣2后,溶液中存在如下反应:2 + 2H+
+ 2H+
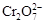 + H2O
+ H2O
③不同钠盐在不同温度下的溶解度如下表:
| 温度 化学式 |
20℃ |
60℃ |
100℃ |
| Na2SO4 |
19.5 |
45.3 |
42.5 |
| Na2Cr2O7 |
183 |
269 |
415 |
| Na2CrO4 |
84 |
115 |
126 |
(1)完成氧化焙烧过程中生成K2CrO4的化学方程式。
 Cr(OH)3+ Na2CO3+ Na2CrO4+ CO2 + ________
Cr(OH)3+ Na2CO3+ Na2CrO4+ CO2 + ________
(2)水浸后的溶液呈 (填“酸”、“碱”、“中”)性,该步骤过滤,在滤渣1中可进一步回收到重金属 。
(3)滤渣2的主要成分有Zn(OH)2、
(4)系列操作中继续加入H2SO4,加热蒸发,冷却结晶,过滤;继续加入H2SO4目的是______,可得到滤渣3的主要成分为 。
(5)工业上还可以在水浸过滤后的Na2CrO4溶液中加入适量H2SO4,用石墨做电极电解生产金属铬,写出生成铬的电极反应方程式:_______________________________。
碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂。工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下: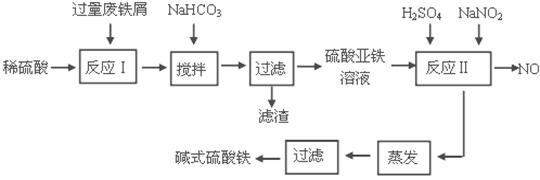
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Al(OH)3 |
| 开始沉淀 |
2.3 |
7.5 |
3.4 |
| 完全沉淀 |
3.2 |
9.7 |
4.4 |
回答下列问题:
(1)加入少量NaHCO3的目的是调节pH在 范围内。
(2)反应Ⅱ中加入NaNO2的目的是氧化亚铁离子,写出该反应的离子方程式为
。
(3)实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,若参与反应的O2体积为 11.2 L(标准状况),则相当于节约NaNO2的物质的量为 。
(4)碱式硫酸铁溶于水后生成的Fe(OH)2+离子可部分水解生成Fe2(OH)42+ 聚合离子,该水解反应的离子方程式为 。
(5)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁。根据我国质量标准,产品中不得含有Fe2+及NO3-。为检验所得产品中是否含有Fe2+,应使用的试剂为 。
A.氯水 B.KSCN溶液 C.NaOH溶液 D.酸性KMnO4溶液
(6)为测定含Fe2+和Fe3+溶液中铁元素的总含量,实验操作如下:准确量取20.00mL溶液于带塞锥形瓶中,加入足量H2O2,调节pH<3,加热除去过量H2O2;加入过量KI充分反应后,再用 0.1000 mol·L-1Na2S2O3标准溶液滴定至终点,消耗标准溶液20.00mL。
已知:
则溶液中铁元素的总含量为 g·L-1。若滴定前溶液中H2O2没有除尽,所测定的铁元素的含量将会
(填“偏高” “偏低” “不变”)
(12分)工业上以碳酸锰矿为主要原料生产MnO2的工艺流程如下:

有关氢氧化物开始沉淀和沉淀完全的pH如下表:
| 氢氧化物 |
Al(OH)3 |
Fe(OH)3 |
Fe(OH)2 |
Pb(OH)2 |
Mn(OH)2 |
| 开始沉淀的pH |
3.3 |
1.5 |
6.5 |
8.0 |
8.3 |
| 沉淀完全的pH |
5.2 |
3.7 |
9.7 |
8.8 |
9.8 |
请问答下列问题:
(1)为了提高锰矿中锰元素的浸取率,可采取的措施为 。
(2)写出焙烧过程反应的化学方程式 。
(3)MnO2粗品中含有少量Mn3O4,可以用稀硫酸处理,将其转化为MnSO4和MnO2,然后再用氧化剂将Mn2+转化为MnO2,制得优质MnO2。写出Mn3O4与稀硫酸反应离子方程式:
。
(4)某兴趣小组在实验室中除去酸浸后的溶液有少量Fe2+、Fe3+.A13+、Pb2+等,得到只含的Mn2+、 SO42-的溶液,其除杂过程设计如下:

①加入MnO2氧化时发生的离子方程式为 。
②试剂X最好选用 (填字母)。
a.NaOH 溶液 b。KMnO4溶液 c。稀硝酸 d.MnCO3
③滤渣的成分是 。
铬铁矿的主要成分可表示为FeO·Cr2O3,还含有SiO2、Al2O3等杂质,以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的过程如下图所示。
已知:① NaFeO2遇水强烈水解。
② Cr2O72-+ H2O 2CrO42-+ 2H+
2CrO42-+ 2H+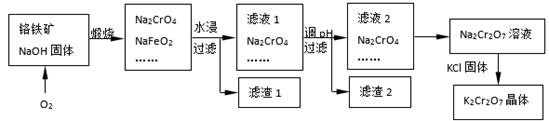
(1)K2Cr2O7中Cr元素的化合价是 。
(2)滤液1的成分除Na2CrO4、Na2SiO3外,还含有(填化学式) ;
生成滤渣1中红褐色物质反应的化学方程式是。
(3)由滤液2转化为Na2Cr2O7溶液应采取的措施是。
(4)煅烧铬铁矿生成Na2CrO4和NaFeO2反应的化学方程式是 。
(5)莫尔法是一种沉淀滴定法,以Na2CrO4 为指示剂,用标准硝酸银溶液滴定待测液,进行测定溶液中Cl-的浓度。已知:
| 银盐 性质 |
AgCl |
AgBr |
AgCN |
Ag2CrO4 |
AgSCN |
| 颜色 |
白 |
浅黄 |
白 |
砖红 |
白 |
| Ksp |
1.34×10-6 |
7.1×10-7 |
1.1×10-8 |
6.5×10-5 |
1.0×10-6 |
①滴定终点的现象是。
②若用AgNO3溶液滴定NaSCN溶液,可选为滴定指示剂的是(选填编号)
A.NaCl B.K2CrO4 C.BaBr2
工业上常回收冶炼锌废渣中的锌(含有ZnO、FeO、Fe2O3、CuO、Al2O3等杂质),并用来生产Zn(NO3)2·6H2O晶体,其工艺流程为: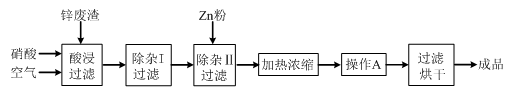
有关氢氧化物开始沉淀和沉淀完全的pH如下表:
| 氢氧化物 |
Al(OH)3 |
Fe(OH)3 |
Fe(OH)2 |
Cu(OH)2 |
Zn(OH)2 |
| 开始沉淀的pH |
3.3 |
1.5 |
6.5 |
4.2 |
5.4 |
| 沉淀完全的pH |
5.2 |
3.7 |
9.7 |
6.7 |
8.0 |
⑴在“酸浸”步骤中,为提高锌的浸出速率,除通入空气“搅拌”外,还可采取的措施是 。
⑵上述工艺流程中多处涉及“过滤”,实验室中过滤操作需要使用的玻璃仪器有 。
⑶在“除杂I”步骤中,需再加入适量H2O2溶液,H2O2与Fe2+反应的离子方程式为 。为使Fe(OH)3、Al(OH)3沉淀完全,而Zn(OH)2不沉淀,应控制溶液的pH范围为 。检验Fe3+是否沉淀完全的实验操作是 。
⑷加入Zn粉的作用是 。“操作A”的名称是 。
铬铁矿的主要成分可表示为FeO·Cr2O3,还含有MgO、Al2O3、Fe2O3等杂质,以下是以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的流程图:
已知:①4FeO•Cr2O3+8Na2CO3+7O2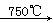 8Na2CrO4+2Fe2O3+8CO2↑;
8Na2CrO4+2Fe2O3+8CO2↑;
②Na2CO3+Al2O3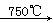 2NaAlO2+CO2↑;
2NaAlO2+CO2↑;
③Cr2CO72-+H2O 2CrO42-+2H+
2CrO42-+2H+
根据题意回答下列问题:
(1)固体X中主要含有 (填写化学式);要检测酸化操作中溶液的pH是否等于4.5,应该使用 ______________ (填写仪器或试剂名称)。
(2)酸化步骤用醋酸调节溶液pH<5,其目的是 _______________________ 。
(3)操作Ⅲ有多步组成,获得K2Cr2O7晶体的操作依次是:加入KCl固体、蒸发浓缩、 、过滤、 、干燥。
(4)下表是相关物质的溶解度数据,操作III发生反应的化学方程式是:Na2Cr2O7 + 2KCl=K2Cr2O7 ↓+ 2NaCl,该反应在溶液中能发生的理由是_____________________________。
| 物质 |
KCl |
NaCl |
K2Cr2O7 |
Na2Cr2O7 |
|
| 溶解度(g/100g水) |
0℃ |
28 |
35.7 |
4.7 |
163 |
| 40℃ |
40.1 |
36.4 |
26.3 |
215 |
|
| 80℃ |
51.3 |
38 |
73 |
376 |
(5)副产品Y主要含氢氧化铝,还含少量镁、铁的难溶化合物及可溶性杂质,精确分析Y中氢氧化铝含量的方法是称取n g样品,加入过量 ____ (填写试剂)、溶解、过滤、再 (填写试剂)、……灼烧、冷却、称量,得干燥固体m g。计算祥品中氢氧化铝的质量分数为 (用含m、n的代数式表示)。
用菱锰矿(MnCO3)常含有Fe2O3、FeO、HgCO3·2HgO等杂质,工业常用菱锰矿制取锰,工艺流程如下: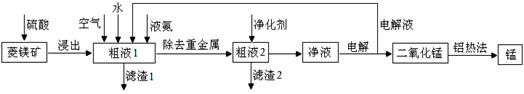
请回答下列问题:
(1)向粗液1中加入的水最后需要 方法才能达到技术要求。
(2)流程中用的空气是用膜分离法制备的富氧空气,该方法的原理是 。
(3)净化剂主要成分为(NH4)2S,粗液2中发生主要反应的离子方程式为 。
(4)写出阳极的电极反应式 。说明电解液循环的原因 。
(5)写出铝热法炼锰的化学方程式 。
用芒硝(Na2SO4 °10H2O)制备纯碱、明矾铵[(NH4)2Al(SO4)2°12H2O]的生产工艺流程如下图:
(1)溶液C中的溶质主要是_____________
(2)明矾铵的溶液呈_____性,明矾铵可用于净水,用离子方程式说明其原理______________________
(3)过程Ⅰ中的反应温度不能超过40℃,其原因是______________________________
(4)运用化学平衡原理解释Na2SO4稍过量的原因
(5)若将Al2(SO4)3加入到A中会产生大量的沉淀和气体,导致明矾铵的产量降低,请用离子方程式解释产生该现象的原因是___________________________________________
(6)溶液E中的溶质离子为__________________
(7)已知明矾铵的溶解度随着温度的升高而增大,过程Ⅱ中得到明矾铵的系列实验操作是: 、 、过滤、洗涤、干燥。
利用酸解法制钛白粉产生的废液[含有大量FeSO4、H2SO4和少量Fe2(SO4)3、TiOSO4],生产铁红和补血剂乳酸亚铁。其生产步骤如下:
已知:TiOSO4可溶于水,在水中可以电离为TiO2+和SO42—。请回答:
(1)步骤①中分离硫酸亚铁溶液和滤渣的操作中所用的玻璃仪器是 。
步骤②得到硫酸亚铁晶体的操作为蒸发浓缩、 。
(1)步骤④的离子方程式是 。
(1)步骤⑥必须控制一定的真空度,原因是有利于蒸发水以及 。
(1)硫酸亚铁在空气中煅烧生成铁红和三氧化硫,该反应中氧化剂和还原剂的物质的量之比为 。
(1)用平衡移动的原理解释步骤⑤中加乳酸能得到乳酸亚铁的原因 。
(1)为测定步骤②中所得晶体中FeSO4·7H2O的质量分数,取晶体样品a g,溶于稀硫酸配成100.00 mL溶液,取出20.00 mL溶液,用KMnO4溶液滴定(杂质与KMnO4不反应)。若消耗0.1000 mol•L-1 KMnO4溶液20.00 mL,所得晶体中FeSO4·7H2O的质量分数为(用a表示) 。
工业上以软锰矿为原料,利用硫酸亚铁制备高纯二氧化锰的流程如下: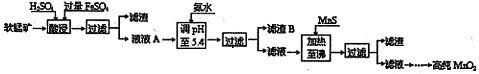
某软锰矿的主要成分为MnO2,还含有Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物。部分阳离子以氢氧化物或硫化物的形式完全沉淀时溶液的pH见下表。
回答下列问题:
(1)硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时发生的主要反应的离子方程式为 。
(2)调节pH时不用氢氧化钠原因是: ,理论上,调节pH的最小值为 ,滤渣B的主要成分是 。
(3)加入MnS的目的是除去 杂质。
(4)碱性锌锰电池中,MnO2参与的电极反应方程式为 。回收废旧碱性锰电池中的锰,可向含锰混合物中加入一定量的稀硫酸、稀草酸,并不断搅拌至无气泡为止,其主要反应为:2MnO(OH)+MnO2 +2H2C2O4 +3H2SO4=3MnSO4 +4CO2 ↑+6H2O,该方法的优点是 。
碱式碳酸铜和氯气都是用途广泛的化工原料。
(1)工业上可用酸性刻蚀废液(主要成分有Cu2+、Fe2+、Fe3+、H +、Cl−)制备碱式碳酸铜,其制备过程如下:
已知:Cu2+、Fe2+、Fe3+生成沉淀的pH如下:
| 物质 |
Cu(OH)2 |
Fe (OH)2 |
Fe (OH)3 |
| 开始沉淀pH |
4.2 |
5.8 |
1.2 |
| 完全沉淀pH |
6.7 |
8.3 |
3.2 |
①氯酸钠的作用是 ;
②反应A后调节溶液的pH范围应为 。
③第一次过滤得到的产品洗涤时,如何判断已经洗净? 。
④造成蓝绿色产品中混有CuO杂质的原因是 。
(2)某学习小组在实验室中利用下图所示装置制取氯气并探究其性质。
①实验室用二氧化锰和浓盐酸加热制取氯气,所用仪器需要检漏的有 。
②若C中品红溶液褪色,能否证明氯气与水反应的产物有漂白性,说明原因 。此时B装置中发生反应的离子方程式是___________ _____。
③写出A溶液中具有强氧化性微粒的化学式 。若向A溶液中加入NaHCO3粉末,会观察到的现象是 。
工业上以黄铁矿为原料生产硫酸主要分为三个阶段进行,即煅烧、催化氧化、吸收。请回答下列问题:
(1)煅烧黄铁矿形成的炉气必须经除尘、洗涤、干燥后进入 (填设备名称),其主要目的是 。
(2)催化氧化所使用的催化剂钒触媒(V2O5)能加快二氧化硫氧化速率,此过程中产生了一连串的中间体(如图1)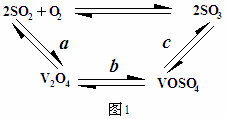
其中a、c二步反应的化学方程式可表示为: 、 。
(3)550℃时,SO2转化为SO3的平衡转化率(α)与体系总压强(P)的关系如图2所示,
则:将2.0mol SO2和1.0mol O2置于5L密闭容器中,反应达平衡后,体系总压强为0.10M Pa,A与B表示不同压强下的SO2转化率,通常情况下工业生产中采用常压的原因是: 。
(4)为循环利用催化剂,科研人员最新研制了一种离子交换法回收钒的新工艺,回收率达91.7%以上。已知废钒催化剂中含有V2O5、VOSO4及不溶性残渣,查阅资料知:VOSO4可溶于水,V2O5难溶于水,NH4VO3难溶于水。该工艺的流程如图如下: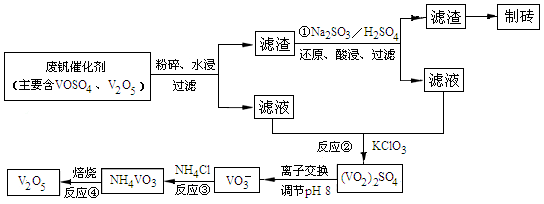
则反应①②③④中属于氧化还原反应的是 (填数字序号),反应①的离子方程式为 ,该工艺中反应③的沉淀率(又称沉钒率)是回收钒的关键之一,沉钒率的高低除受溶液pH影响外,还需要控制氯化铵系数(NH4Cl加入质量与料液中V2O5的质量比)和温度。根据下图试建议控制氯化铵系数和温度: 、 。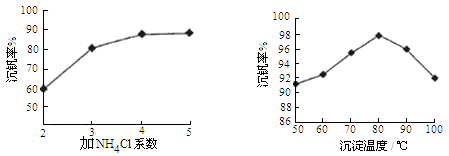
氧化镁在医药、建筑等行业应用广泛。硫酸镁还原热解制备高纯氧化镁是一种新的探索。以菱镁矿(主要成分为MgCO3,含少量FeCO3 )为原料制备高纯氧化镁的实验流程如下:

(1)MgCO3与稀硫酸反应的离子方程式为 。
(2)加入H2O2氧化时,发生反应的化学方程式为 。
(3)滤渣2 的成分是 (填化学式)。
|
(4)煅烧过程存在以下反应:
|
2MgSO4+C="==" ="==" 2MgO+2SO2↑+CO2↑
|
MgSO4+C="==" ="==" MgO+SO2↑+CO↑
MgSO4+3C="==" ="==" MgO+S↑+3CO↑
酸性锌锰干电池是一种一次电池,外壳为金属锌,中间是碳棒,其周围是碳粉,MnO2,ZnCl2和NH4Cl等组成的糊状填充物,该电池在放电过程产生MnOOH,回收处理该废电池可得到多种化工原料,有关数据下表所示:
溶解度/(g/100g水)
 温度/℃ 温度/℃化合物 |
0 |
20 |
40 |
60 |
80 |
100 |
| NH4Cl |
29.3 |
37.2 |
45.8 |
55.3 |
65.6 |
77.3 |
| ZnCl2 |
343 |
395 |
452 |
488 |
541 |
614 |
| 化合物 |
Zn(OH)2 |
Fe(OH)2 |
Fe(OH)3 |
| Ksp近似值 |
10-17 |
10-17 |
10-39 |
回答下列问题:
(1)该电池的正极反应式为 ,电池反应的离子方程式为:
(2)用废电池的锌皮制备ZnSO4·7H2O的过程中,需去除少量杂质铁,其方法是:加稀硫酸和H2O2溶解,铁变为_____,加碱调节至pH为 时,铁刚好完全沉淀(离子浓度小于1×10-5mol/L时,即可认为该离子沉淀完全);继续加碱调节至pH为_____时,锌开始沉淀(假定Zn2+浓度为0.1mol/L)。若上述过程不加H2O2后果是 ,原因是 。
碱式碳酸铜[CuCO3·Cu(OH)2]是一种用途广泛的化工原料,可用于作有机催化剂、颜料制造、原油贮存时脱碱等。用废杂铜(主要成分为Cu,还含有少量杂质Fe)制取碱式碳酸铜的工艺流程如图所示。
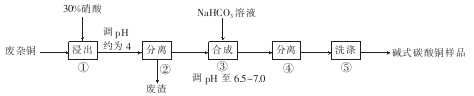
(1)步骤①浸出时,硝酸浓度不易过大,其原因是____。
(2)步骤②分离前需将溶液pH调节在4左右,其目的是 ,所得废渣的主要成分为____________。
(3)步骤③合成时,采用将NaHCO3溶液迅速投入Cu(NO3)2溶液中,其主要原因是 ;合成时发生反应的化学方程式为____________。
(4)本实验中两次用到固液分离,本实验中最适合固液分离的设备是____________。
(5)步骤⑤洗涤主要除去的杂质离子是 。
(6)准确称取所得产品m g,放入碘量瓶中,加入2 g KI及5 ml3 mol/L稀硫酸(两试剂均过量)摇匀并静置10 min(2Cu2++4I-=2CuI↓+I2),再加入2 mL淀粉溶液,用c mol/L的Na2S2O3标准溶液滴定(I2+2S2O32-=2I-+S4O62-),到滴定终点时消耗Na2S2O3标准溶液V mL,则样品中铜元素的质量分数为________。