山东省青岛市高三3月第一次模拟考试(第二套)理综化学试卷
化学与环境、材料、信息、能源关系密切,下列说法正确的是
| A.导致青岛开发区石油管线爆炸的非甲烷总烃在日光照射下会产生光化学烟雾 |
| B.塑化剂是一种应用很广的化工塑料软化剂,可大量添加到婴幼儿玩具中 |
| C.航天员太空实验能够证明水分子组成和结构在太空中发生改变 |
| D.汽油标准已由“国Ⅲ”提到“国Ⅳ”,这意味着汽车不再排放氮氧化物 |
A、B、C是原子序数依次增大的短周期元素,A元素某种同位素原子在考古方面有重要应用,B的最外层电子是电子层数的三倍,C的焰色反应呈黄色,下列说法正确的是
A.元素A在周期表中的位置为第2周期VIA族
B.元素A、B、C的原子半径由大到小的顺序为r(C) > r(B) > r(A)
C.A、B两种元素的氢化物的稳定性A>B
D.1 molC2B2与足量的AB2完全反应转移约6.02 ×1023个电子
有关物质性质及用途的说法,正确的是
| A.甲烷与氯气在光照的条件下可以制取纯净的一氯甲烷 |
| B.将溴水加入苯中,溴水的颜色变浅,这是由于发生了加成反应 |
| C.牡丹籽油是一种优良的植物油脂,它可使酸性高锰酸钾溶液褪色 |
| D.等质量的乙烯和聚乙烯充分燃烧所需氧气的量不相等 |
CuSO4溶液中加入过量KI溶液,产生白色CuI沉淀,溶液变棕色。向反应后溶液中通入过量SO2,溶液变成无色。下列说法不正确的是
| A.滴加KI溶液时,KI被氧化,CuI是还原产物 |
| B.通入SO2后,溶液变无色,体现SO2的还原性 |
| C.整个过程发生了复分解反应和氧化还原反应 |
| D.上述实验条件下,物质的氧化性:Cu2+>I2>SO2 |
用下表提供的仪器和药品,能达到实验目的的是
| 编号 |
仪器 |
药品 |
实验目的 |
| A |
烧杯、分液漏斗、胶头滴管、铁架台 |
待提纯的AlCl3溶液、NaOH溶液 |
提纯混有MgCl2杂质的AlCl3溶液 |
| B |
分液漏斗、烧瓶、锥形瓶、导管及橡皮塞 |
盐酸、大理石、 碳酸钠溶液 |
证明非金属性:Cl>C>Si |
| C |
酸式滴定管、胶头滴管、铁架台(带铁夹) |
已知浓度的盐酸、 待测NaOH溶液 |
测定NaOH溶液的物质的量浓度 |
| D |
酒精灯、玻璃棒、 蒸发皿、铁架台(带铁圈) |
NaCl溶液 |
蒸发溶液得到晶体 |
通过NOx传感器可监测NOx的含量,其工作原理示意图如下,下列说法不正确的是 
| A.Pt电极是该装置的正极 |
| B.该电池发生的正极反应为:O2 + 4e−+ 2H2O = 4OH− |
| C.负极的电极反应式:NO−2e−+O2−= NO2 |
| D.固体电解质中O2−向负极移动 |
溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32−、SO42−、NO3−中的几种。①加入铝片,产生无色无味的气体;②加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示。则下列说法正确的是
| A.溶液中一定不含CO32−,可能含有SO42−和NO3− |
| B.在滴加NaOH溶液物质的量为0.5至0.7mol时,发生的离子反应为:Al3++4OH-=[Al(OH)4 ]- |
| C.溶液中的阳离子只有H+、Mg2+、Al3+ |
| D.n(H+)∶n(NH4+)∶n(Mg2+) =2∶4∶1 |
液氨常用作制冷剂,回答下列问题
(1)一定条件下在密闭容器中发生反应:
a.NH4I(s) NH3(g) + HI(g) b.2HI(g)
NH3(g) + HI(g) b.2HI(g)  H2(g) + I2(g)
H2(g) + I2(g)
①写出反应a的平衡常数表达式
②达到平衡后,扩大容器体积,反应b的移动方向 (填“正向”、“逆向”或“不移动”),达到新的平衡时容器内颜色将怎样变化 (填“加深”、“变浅”或“不变”)
(2)工业上合成氨的反应:N2(g)+3H2(g)  2NH3(g) ΔH=-92.60 kJ·mol-1
2NH3(g) ΔH=-92.60 kJ·mol-1
下列说法能说明上述反应向正反应方向进行的是________(填序号)。
a.单位时间内生成2n mol NH3的同时生成3n mol H2
b.单位时间内生成6n mol N—H键的同时生成2n mol H—H键
c.用N2、H2、NH3的物质的量浓度变化表示的反应速率之比为1∶3∶2
d.混合气体的平均摩尔质量增大
e.容器内的气体密度不变
(3)已知合成氨反应在某温度下2 L的密闭容器中进行,测得如下数据:
| 时间(h) 物质的量(mol) |
0 |
1 |
2 |
3 |
4 |
| N2 |
1.50 |
n1 |
1.20 |
n3 |
1.00 |
| H2 |
4.50 |
4.20 |
3.60 |
n4 |
3.00 |
| NH3 |
0 |
0.20 |
|
1.00 |
1.00 |
根据表中数据计算:
①反应进行到2 h时放出的热量为________ kJ。
②0~1 h内N2的平均反应速率为________ mol·L-1·h-1。
③此温度下该反应的化学平衡常数K=________(保留两位小数)。
④反应达到平衡后,若往平衡体系中再加入N2、H2和NH3各1.00 mol,化学平衡将向________方向移动(填“正反应”或“逆反应”)。
(4)肼(N2H4)的性质类似于NH3,极易溶于水,与水反应生成一种二元弱碱在溶液中分步电离,请用离子反应方程式表示其水溶液显碱性的原因
硫单质及其化合物在工农业生产中有着重要的应用。
(1)已知25℃时:SO2(g)+2CO(g)=2CO2(g)+1/xSx(s) △H=akJ/mol
2COS(g)+SO2(g)=2CO2(g)+3/xSx(s) △H=bkJ/mol。
则COS(g)生成CO(g)与Sx(s)反应的热化学方程式是 。
(2)雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料。已知As2S3和HNO3有如下反应:As2S3+10H++ 10NO3−=2H3AsO4+3S+10NO2↑+ 2H2O,当生成H3AsO4的物质的量为0.6 mol反应中转移电子的数目为 ,
(3)向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸至过量。其中H2S、HS−、S2−的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与滴加盐酸体积的关系如下图所示(忽略滴加过程H2S气体的逸出)。
①B表示 。
②滴加过程中,溶液中微粒浓度大小关系正确的是 (填字母)。
a.c(Na+)= c(H2S)+c(HS−)+2c(S2−)
b.2c(Na+)=c(H2S)+c(HS−)+c(S2−)
c.c(Na+)=3[c(H2S)+c(HS−)+c(S2−)]
③NaHS溶液呈碱性,当滴加盐酸至M点时,溶液中各离子浓度由大到小的顺序为 。
(4)工业上用硫碘开路循环联产氢气和硫酸的工艺流程如下图所示: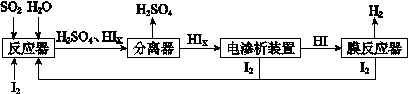
① 写出反应器中发生反应的化学方程式是 。
② 电渗析装置如图所示,写出阳极的电极反应式 。该装置中发生的总反应的化学方程式是 。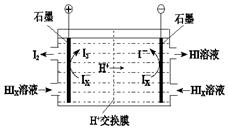
碱式碳酸铜和氯气都是用途广泛的化工原料。
(1)工业上可用酸性刻蚀废液(主要成分有Cu2+、Fe2+、Fe3+、H +、Cl−)制备碱式碳酸铜,其制备过程如下:
已知:Cu2+、Fe2+、Fe3+生成沉淀的pH如下:
| 物质 |
Cu(OH)2 |
Fe (OH)2 |
Fe (OH)3 |
| 开始沉淀pH |
4.2 |
5.8 |
1.2 |
| 完全沉淀pH |
6.7 |
8.3 |
3.2 |
①氯酸钠的作用是 ;
②反应A后调节溶液的pH范围应为 。
③第一次过滤得到的产品洗涤时,如何判断已经洗净? 。
④造成蓝绿色产品中混有CuO杂质的原因是 。
(2)某学习小组在实验室中利用下图所示装置制取氯气并探究其性质。
①实验室用二氧化锰和浓盐酸加热制取氯气,所用仪器需要检漏的有 。
②若C中品红溶液褪色,能否证明氯气与水反应的产物有漂白性,说明原因 。此时B装置中发生反应的离子方程式是___________ _____。
③写出A溶液中具有强氧化性微粒的化学式 。若向A溶液中加入NaHCO3粉末,会观察到的现象是 。
用菱锰矿(MnCO3)常含有Fe2O3、FeO、HgCO3·2HgO等杂质,工业常用菱锰矿制取锰,工艺流程如下: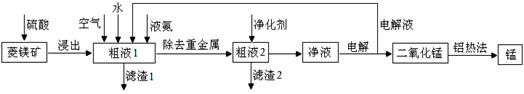
请回答下列问题:
(1)向粗液1中加入的水最后需要 方法才能达到技术要求。
(2)流程中用的空气是用膜分离法制备的富氧空气,该方法的原理是 。
(3)净化剂主要成分为(NH4)2S,粗液2中发生主要反应的离子方程式为 。
(4)写出阳极的电极反应式 。说明电解液循环的原因 。
(5)写出铝热法炼锰的化学方程式 。
已知:硫酸铜溶液中滴入氨基乙酸钠(H2N—CH2—COONa)即可得到配合物A。其结构如图:
(1)Cu元素基态原子的外围电子排布式为 。
(2)1mol氨基乙酸钠中含有σ键的数目为 。
(3)氨基乙酸钠分解产物之一为二氧化碳,写出二氧化碳的一种等电子体 (写化学式)。已知二氧化碳在水中溶解度不大,却易溶于二硫化碳,请解释原因 。
(4)硫酸根离子的空间构型为 ;已知:硫酸铜灼烧可以生成一种红色晶体,其结构如图,则该化合物的化学式是 。
 ,合成路线如下
,合成路线如下
 粤公网安备 44130202000953号
粤公网安备 44130202000953号