广东省十校联考高三下学期理综化学试卷
下列微粒在水溶液中能大量共存的是
| A.Fe3+、H+、I-、Na+ |
| B.Al3+、Na+、AlO2-、SO42- |
| C.K+、NH4+、H+、CO32— |
| D.Cu2+、SO42—、Al3+、Cl— |
下列说法正确的是
| A.煤经处理变为气体燃料的过程属于物理变化 |
| B.淀粉、油脂和蛋白质都是高分子化合物 |
| C.乙烯和乙醇均可使酸性KMnO4溶液褪色 |
| D.乙酸乙酯和植物油均可水解生成乙醇 |
下列措施不合理的是
| A.用饱和Na2CO3溶液除去乙酸乙酯中的乙酸 |
| B.用酸性高锰酸钾溶液鉴别苯和甲苯 |
| C.实验室用稀盐酸与MnO2混合加热制备Cl2 |
| D.用CCl4萃取碘水中的碘 |
设NA为阿伏加德罗常数的数值,下列说法正确的是
| A.1molH2O2中含有的电子数为16NA |
| B.标准状况下,11.2L Br2中含Br—Br键数为0.5NA |
| C.1 mol Fe与足量稀HNO3反应,转移3 NA个电子 |
| D.1 L 0.1 mol ·L-1NaHCO3溶液中含有0.1NA 个HCO3 — |
下列陈述I、II正确并且有因果关系的是
| 选项 |
陈述I |
陈述II |
| A |
Fe3+有氧化性 |
实验室常用KSCN溶液检验Fe3+ |
| B |
SO2有较强的还原性 |
SO2可使酸性KMnO4溶液褪色 |
| C |
Mg有还原性 |
电解MgCl2饱和溶液可制备Mg |
| D |
浓H2SO4有吸水性 |
浓H2SO4可用于干燥氨气 |
常温时,下列各溶液中,离子的物质的量浓度关系正确的是
| A.饱和碳酸钠溶液中:c(Na+)= 2c(CO32-)+ 2c(HCO3-)+2c(H2CO3) |
| B.pH=2的醋酸中:c(H+)=0.02mol•L-1 |
| C.0.1 mol•L-1氯化铵溶液中:c(H+)> c(OH-)> c(Cl-)> c(NH4+) |
| D.pH=12的NaOH溶液与等体积0.01 mol·L-1氯化铵溶液混合后所得溶液中:c(Na+) = c(NH4+) |
已知短周期元素甲、乙、丙、丁、戊的原子序数依次增大,其氢化物中甲、乙、丙、丁、戊的化合价如下,下列说法不正确的是
| 元素 |
甲 |
乙 |
丙 |
丁 |
戊 |
| 化合价 |
-3 |
-2 |
+1 |
-4 |
-1 |
A.丙的常见氧化物有两种
B.气态氢化物稳定性:甲>乙
C.丁的氧化物能与戊的氢化物的水溶液反应
D.原子半径大小:甲<丙
下列实验“操作和现象”与“结论”对应关系正确的是
| |
操作和现象 |
结论 |
| A |
常温下将Al片放入浓硝酸中,无明显变化 |
Al与浓硝酸不反应 |
| B |
向0.1mol·L-1 Na2CO3溶液中,滴加2滴酚酞显浅红色,微热, 红色加深。 |
说明盐类水解是吸热反应 |
| C |
向FeCl3溶液加入足量的铜粉,充分反应,静置,取上层清液 滴加几滴KSCN溶液,溶液不变血红色。 |
说明氧化性:Fe3+>Cu2+ |
| D |
向某溶液先滴加硝酸酸化,再滴加BaCl2溶液,有白色沉淀生成 |
该溶液中一定含有SO42- |
香豆素(结构如下图中Ⅰ所示)是用途广泛的香料,由香豆素经下列图示的步骤可转变为水杨酸。 已知:CH3CH=CHCH2CH3
已知:CH3CH=CHCH2CH3 CH3COOH+CH3CH2COOH
CH3COOH+CH3CH2COOH
请回答下列问题:
(1)化合物Ⅱ分子中的含氧官能团的名称为 ,由乙二酸生成高分子化合物Ⅴ的反应类型为。
(2)下列关于有机物Ⅰ、Ⅱ、Ⅲ、Ⅳ的叙述中正确的是(选填编号)
| A.1molⅠ最多能和5mol H2发生加成反应 | B.可用FeCl3溶液来鉴别Ⅱ和Ⅲ |
| C.Ⅳ中核磁共振氢谱共有4种峰 | D.Ⅰ、Ⅱ、Ⅲ均可使溴的四氯化碳溶液褪色 |
(3)香豆素在过量NaOH溶液中完全水解的化学方程式为
(4)Ⅲ的结构简式为 ,在上述转化过程中,设计反应步骤Ⅱ→Ⅲ的目的是 。
(5)化合物Ⅳ有多种同分异构体,请写出其中一种符合下列条件的同分异构体的结构简式: 。
①是苯的对位二取代物;②水解后生成的产物之一能发生银镜反应。
以CO2为碳源制取低碳有机物成为国际研究焦点,下面为CO2加氢制取低碳醇的热力学数据:
反应Ⅰ: CO2(g)+3H2(g) CH3OH(g)+H2O(g) ∆H = —49.0 kJ·mol-1
CH3OH(g)+H2O(g) ∆H = —49.0 kJ·mol-1
反应Ⅱ:2CO2(g)+6H2(g) CH3CH2OH(g)+3H2O(g) ∆H = —173.6 kJ·mol-1
CH3CH2OH(g)+3H2O(g) ∆H = —173.6 kJ·mol-1
(1)写出由CH3OH(g)合成CH3CH2OH(g)的热化学反应方程式:
(2)对反应Ⅰ,在一定温度下反应达到平衡的标志是 (选填编号)
a.反应物不再转化为生成物 b.平衡常数K不再增大
c.CO2的转化率不再增大 d.混合气体的平均相对分子质量不再改变
(3)在密闭容器中,反应Ⅰ在一定条件达到平衡后,其它条件恒定,能提高CO2转化率的措施是 (选填编号)
| A.降低温度 | B.补充CO2 | C.加入催化剂 | D.移去甲醇 |
(4)研究员以生产乙醇为研究对象,在密闭容器中,按H2与CO2的物质的量之比为3:1进行投料,在5MPa下测得不同温度下平衡体系中各种物质的体积分数(y%)如下图所示。表示CH3CH2OH组分的曲线是 ;图中曲线Ⅱ和Ⅲ的交点a对应的体积分数ya= %(计算结果保留三位有效数字)
(5)一种以甲醇作燃料的电池示意图如图。写出该电池放电时负极的电极反应式: 。
铬铁矿的主要成分可表示为FeO·Cr2O3,还含有SiO2、Al2O3等杂质,以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的过程如下图所示。
已知:① NaFeO2遇水强烈水解。
② Cr2O72-+ H2O 2CrO42-+ 2H+
2CrO42-+ 2H+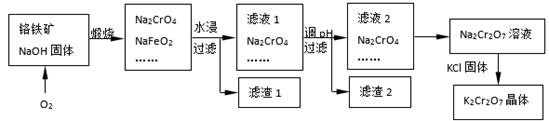
(1)K2Cr2O7中Cr元素的化合价是 。
(2)滤液1的成分除Na2CrO4、Na2SiO3外,还含有(填化学式) ;
生成滤渣1中红褐色物质反应的化学方程式是。
(3)由滤液2转化为Na2Cr2O7溶液应采取的措施是。
(4)煅烧铬铁矿生成Na2CrO4和NaFeO2反应的化学方程式是 。
(5)莫尔法是一种沉淀滴定法,以Na2CrO4 为指示剂,用标准硝酸银溶液滴定待测液,进行测定溶液中Cl-的浓度。已知:
| 银盐 性质 |
AgCl |
AgBr |
AgCN |
Ag2CrO4 |
AgSCN |
| 颜色 |
白 |
浅黄 |
白 |
砖红 |
白 |
| Ksp |
1.34×10-6 |
7.1×10-7 |
1.1×10-8 |
6.5×10-5 |
1.0×10-6 |
①滴定终点的现象是。
②若用AgNO3溶液滴定NaSCN溶液,可选为滴定指示剂的是(选填编号)
A.NaCl B.K2CrO4 C.BaBr2
某研究小组对“Br2和I2能否将Fe2+氧化为Fe3+”这一课题进行实验和探究。请你完成相关问题的回答。
(1)提出合理的假设
假设1: Br2和I2都可以将Fe2+氧化为Fe3+;
假设2: Br2和I2都不能将Fe2+氧化为Fe3+;
假设3:
(2)实验验证
在大试管中加适量铁粉,加入10 mL 稀硫酸,振荡试管,充分反应后,铁粉有剩余,将所得的FeSO4溶液稀释到200mL,备用。
实验Ⅰ:向试管1中加入2 mL浅绿色的 FeSO4溶液,再滴加少量红棕色的溴水,振荡试管,溶液为黄色;
实验Ⅱ:向试管2中加入2 mL浅绿色的 FeSO4溶液,再滴加少量棕黄色的碘水,振荡试管,溶液为黄色。
(3)对实验现象的分析与讨论
①甲同学认为实验Ⅰ的现象说明溴水能将Fe2+氧化,离子方程式为 。
②乙同学认为应该补充实验,才能得出甲的结论。乙的实验操作以及预期现象是 。
③该小组同学对实验Ⅱ中溶液呈黄色的原因展开了讨论:
可能1:碘水与 FeSO4溶液不反应,黄色是碘水稀释后的颜色。
可能2: 。
丙同学和丁同学分别设计了以下实验方案以确定可能的原因。
丙方案:向试管2所得溶液中继续加入0.5mLCCl4,充分振荡,静置一段时间后。取出上层溶液,滴加几滴KSCN 溶液;
丁方案:向试管2所得溶液中继续加入加入0.5mL乙酸乙酯,充分振荡,静置一段时间后。取出下层溶液,滴加几滴KSCN 溶液;
你认为 方案为最佳方案,理由是 。
(4)拓展延伸
①为准确测定此实验所用的FeSO4溶液的浓度,某同学补充了以下实验:
滴定:量取20.00mL稀释后得到的溶液于锥形瓶中,将0.0200mol/LKMnO4标准溶液装入50mL中,滴定至终点,记录数据。重复滴定2次。平均消耗KMnO4溶液V mL。
②计算:此实验中所用的FeSO4溶液的物质的量浓度= mol/L(要求只列出算式,不需运算)。
(已知反应式:Fe2+ + MnO4- +H+ — Fe3+ + Mn2+ + H2O,未配平)
 粤公网安备 44130202000953号
粤公网安备 44130202000953号