某化工厂以软锰矿、闪锌矿(除主要成分为MnO2、ZnS外还含有少量的FeS、CuS、Al2O2等物质)为原料制取Zn和MnO2.
(1)在一定条件下,将这两种矿粉在硫酸溶液中相互作用,配平如下的化学方程式:

(2)将所得含有Mn2+、Fe3+、Cu2+、Al3+、Zn2+的酸性溶液按图1的工业流程进行处理得到溶液(Ⅳ)、电解溶液(Ⅳ)即得MnO2和Zn.
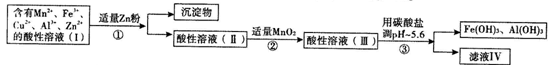
a.操作中①中加Zn粉后发生反应的离子方程式为: 、 .
b.操作②中加入MnO2的作用是 ;反应的离子方程式是 .
c.操作③中所加碳酸盐的化学式是 .
(3)电解法制备高锰酸钾的实验装置示意图(图中阳离子交换膜只允许K+离子通过):

①阳极的电极反应式为 .
②若电解开始时阳极区溶液为1.0L0.40mol/LK2MnO4溶液,电解一段时间后,溶液中 为6:5,阴极区生成生成KOH的质量为 .(计算结果保留3位有效数字)
为6:5,阴极区生成生成KOH的质量为 .(计算结果保留3位有效数字)
(4)已知25℃时,Ksp[Mg(OH)2]=5.6×10﹣12,Ksp[Cu(OH)2]=2.2×10﹣20,Ksp[Fe(OH)3]=4.0×10﹣38,Ksp[Al(OH)3]=1.1×10﹣33,
①在25℃下,向浓度均为0.1mol•L﹣1的AlCl3和CuCl2混合溶液中逐滴加入氨水,先生成 沉淀(填化学式)
②用MgCl2和AlCl3的混合溶液(A)与过量氨水(B)反应,为使Mg2+、Al3+同时生成沉淀,应先向沉淀反应器中加入 反应物.
③溶液中某离子物质的量浓度低于1.0×10﹣5mol•L﹣1时,可认为已沉淀完全.现向一定浓度的AlCl3和FeCl3的混合溶液中逐滴加入氨水,当Fe3+完全沉淀时,测定c(Al3+)=0.2mol•L﹣1.此时所得沉淀中 (填“还含有”或“不含有”)Al(OH)3.
硫酸锌是制备荧光粉的原料之一。工业上由锌白矿(主要成分是ZnO,还含有Fe2O3、CuO、SiO2等杂质)制备ZnSO4•7H2O的流程如下。

已知:常温下,溶液中的Fe3+、Zn2+、Fe2+以氢氧化物形式完全沉淀的pH分别为:3.7,6.5,9.7。
(1)浸取过程中提高浸出效率可采用的措施有 (任答一条),ZnO和硫酸反应的化学方程式为 。
(2)加入适量锌粉的作用为:①使溶液中的Fe3+转化为Fe2+;② 。
(3)氧化过程中H2O2发生反应的离子方程式为 。
(4)加入适量Ca(OH)2调节溶液pH,促进Fe3+水解,Fe3+水解反应的平衡常数表达式K= ,Ca(OH)2不能过量的原因是 。
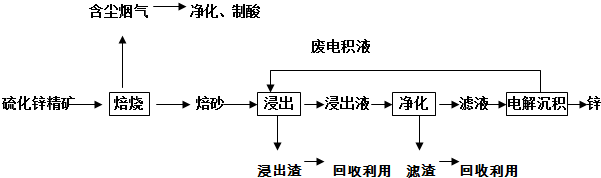
锌是一种应用广泛的金属,目前工业上主要采用“湿法”工艺冶炼锌。某含锌矿的主要成分为ZnS(还含少量FeS等其他成分),以其为原料冶炼锌的工艺流程如图所示:
回答下列问题:
(1)硫化锌精矿的焙烧在氧气气氛的沸腾炉中进行,所产生焙砂的主要成分的化学式为 。
(2)焙烧过程中产生的含尘烟气可净化制酸,该酸可用于后续的_______操作。
(3)浸出液“净化”过程中加入的主要物质为锌粉,其作用是__________________,反应的离子方程式为 。
(4)电解沉积过程中的阴极采用铝板,阳极采用Pb-Ag合金惰性电极,阳极逸出的气体是 。
(5)改进的锌冶炼工艺,采用了“氧压酸浸”的全湿法流程,既省略了易导致空气污染的焙烧过程,又可获得一种有工业价值的非金属单质。“氧压酸浸”中发生的主要反应的离子方程式为________。
(6)我国古代曾采用“火法”工艺冶炼锌。明代宋应星著的《天工开物》中有关于 “升炼倭铅”的记载:“炉甘石十斤,装载入一泥罐内,……,然后逐层用煤炭饼垫盛,其底铺薪,发火煅红,……,冷淀,毁罐取出,……,即倭铅也。”该炼锌工艺过程主要反应的化学方程式为 。(注:炉甘石的主要成分为碳酸锌,倭铅是指金属锌,碳生成CO)
锆(Zr)元素是核反应堆燃料棒的包裹材料,二氧化锆(ZrO2)可以制造耐高温纳米陶瓷。我国有丰富的锆英石(ZrSiO4)含Al2O3、SiO2、Fe2O3等杂质,碱熔法生产锆的流程如下:

已知25℃时部分阳离子以氢氧化物形式完全沉淀时溶液的pH见下表:
| 沉淀物 |
Zr(OH)4 |
Fe(OH)3 |
Al(OH)3 |
Fe(OH)2 |
| 开始沉淀时pH |
1.2 |
2.7 |
3.4 |
6.3 |
| 完全沉淀时pH |
2.4 |
3.2 |
5.2 |
9.7 |
(1)完成高温熔融时的主要反应方程式:ZrSiO4 + 4NaOH = Na2ZrO3 + +
(2)为了提高浸出率可采取的方法有 、 (列举两种)
(3)生成滤渣2的成分 (用化学式表示)
(4)用氨水将滤液2的pH调至 ≤pH< ,目的是 。
(5)往流程中滤渣1中加入盐酸溶液,过滤不溶物后,再将滤液在不断通入 气流同时蒸发结晶,可回收得到铁的氯化物FeCl3晶体。
石墨在材料领域有重要应用,某初级石墨中含SiO2(7.8%)、Al2O3(5.1%)、Fe2O3(3.1%)和MgO(0.5%)等杂质,设计的提纯与综合利用工艺如下:

(注:SiCl4的沸点为57.6℃,金属氯化物的沸点均高于150℃)
(1)向反应器中通入Cl2前,需通一段时间N2,主要目的是_________________。
(2)高温反应后,石墨中氧化物杂质均转变为相应的氯化物,写出由气体II中某物质得到水玻璃的化学反应方程式为_________________。
(3)步骤①为:搅拌、过滤,所得溶液IV中的三种阴离子是____________。
(4)由溶液IV生成沉淀V的反应的离子方程式为_____________,100kg初级石墨最多可获得V的质量为___________kg。

(5)使用上面提纯得到的石墨电极电解NO可制得 NH4NO3酸性溶液,其工作原理如下图所示,① 试写出电解池阴极的电极反应式 。② 为使电解产物全部转化为NH4NO3,需补充物质A,A是 ,说明理由: 。
镍是有机合成的重要催化剂,某化工厂有含镍催化剂废品(主要成分是镍、杂质是铁、铝单质及其化合物,还有少量难溶性杂质)。某学习小组设计如下流程利用含镍催化剂废品制备硫酸镍晶体:

几种难溶碱开始沉淀和完全沉淀的pH:
| 沉淀物 |
开始沉淀 |
完全沉淀 |
| Al(OH)3 |
3.8 |
5.2 |
| Fe(OH)3 |
2.7 |
3.2 |
| Fe(OH)2 |
7.6 |
9.7 |
| Ni(OH)2 |
7.1 |
9.2 |
回答下列问题:
(1)溶液①中含金属元素的离子是_________________。
(2)用离子方程式表示加入双氧水的目的___________;双氧水可以用下列物质替代的是_______。
A.氧气 B.漂白液 C.氯气 D.硝酸
(3)操作a和c需要共同的玻璃仪器是_____________;操作C的名称是______________。
(4)如果加入双氧水量不足或“保温时间较短”,则所制备的产品可能含有的杂质为_____________;请选择合适的试剂,设计实验证明产品中是否含“杂质” ______________。
(5)含镍金属氢化物MH-Ni燃料电池是一种绝色环保电池,广泛应用于电动汽车。其中M代表储氢合金,MH代表金属氢化物,电解质溶液可以是KOH水溶液.它的充、放电反应为:xNi(OH)2+M  MHx+xNiOOH;电池充电过程中阳极的电极反应式为_____________,放电时负极的电极反应式为___________。
MHx+xNiOOH;电池充电过程中阳极的电极反应式为_____________,放电时负极的电极反应式为___________。
碱式氧化镍(NiOOH)可用作镍氢电池的正极材料。以含镍(Ni2+)废液为原料生产NiOOH的一种工艺流程如下:
(1)加入Na2CO3溶液时,确认Ni2+已经完全沉淀的实验方法是______________________________,过滤时需用到的玻璃仪器有烧杯、_______________________。
(2)写出碳酸镍与稀硫酸反应的离子方程式:_____________________。
(3)硫酸镍溶液可用于制备合成氨的催化剂ConNi(1-n) Fe2 O4。如图表示在其他条件相同时合成氨的相对初始速率随催化 剂中n值变化的曲线,由图分析可知Co2+、 Ni2+两种离子中催化效果更好的是_________。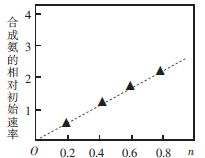
(4)写出在空气中加热Ni(OH)2制取NiOOH的化学方程式:__________________________。
铁及其化合物在日常生活中应用广泛,请根据下列实验回答问题:
(1)钢铁在潮湿的空气中发生吸氧腐蚀的正极反应式为 。
(2)生铁中含有一种铁碳化合物X(Fe3C),X在足量的空气中高温煅烧,生成有磁性氧化物Y,Y可溶于过量盐酸,形成黄绿色的溶液,写出Y与盐酸反应的化学方程式 。
(3)某炼铁废渣中含有大量CuS及少量铁的化合物,工业上以该废渣为原料生产CuCl2·H2O的工艺流程如下:
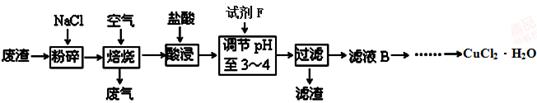
已知:Fe(OH)2、Fe(OH)3、Cu(OH)2沉淀完全时的pH值分别为9.7、3.3、6.4。
试回答下列问题:
①试剂F应选用 (填编号)。
A.Cl2 B.NaClO C.HNO3 D.浓硫酸
理由是 。
②为了获得晶体,对滤液B进行的操作是蒸发浓缩,趁热过滤,滤液经冷却结晶,过滤得到产品。分析有关物质的溶解度曲线(如图),“趁热过滤”得到的固体是 。

以含钴废催化剂(主要成分为Co、Fe、SiO2)为原料,制取氧化钴的流程如下: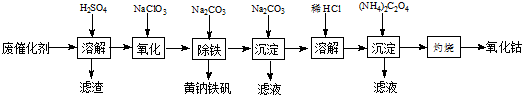
(1)溶解:溶解后过滤,将滤渣洗涤2~3次,洗液与滤液合并,其目的是_________________,所得滤渣的主要成分是_________(写化学式)。
(2)氧化:加热搅拌条件下加入NaClO3,将Fe2+氧化成Fe3+,其离子方程式_________________。
已知:铁氰化钾化学式为K3[Fe(CN)6];亚铁氰化钾化学式为K4[Fe(CN)6]•3H2O.
3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓(蓝色沉淀)
4Fe3++3[Fe(CN)6]4-=Fe4[Fe(CN)6]3↓(蓝色沉淀)
确定Fe2+是否氧化完全的方法是______________。(可供选择的试剂:铁氰化钾溶液、亚铁氰化钾溶液、铁粉、KSCN溶液)
(3)除铁:加入适量的Na2CO3调节酸度,生成黄钠铁矾[Na2Fe6(SO4)4(OH)12]沉淀,写出该反应的化学方程式______________。
(4)沉淀:生成沉淀碱式碳酸钴[(CoCO3)2•3Co(OH)2],沉淀需洗涤,洗涤的操作是______________。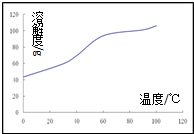
(5)溶解:CoCl2的溶解度曲线如图所示向碱式碳酸钴中加入足量稀盐酸,边加热边搅拌至完全溶解后,需趁热过滤,其原因是______________。
(6)灼烧:准确称取所得CoC2O4 1.470g,在空气中充分灼烧得0.830g氧化钴,写出氧化钴的化学式_________。
利用钛白工业的副产品FeSO4(含少量重金属离子)可以生产电池级高纯超微细草酸亚铁。其工艺流程如下:
已知:①5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O
②5C2O42-+2MnO4-+16H+═10CO2↑+2Mn2++8H2O
(1)沉淀过程的反应温度为40℃,温度不宜过高的原因除了控制沉淀的粒径外,还有___________;
(2)滤液经处理可得到副产品___________;
(3)实验室测定高纯超微细草酸亚铁组成的步骤依次为:
步骤1:准确称量一定量草酸亚铁样品,加入25mL 2mol/L的H2SO4溶解
步骤2:用0.2000mol/L标准KMnO4溶液与其反应,消耗其体积30.40mL。
步骤3:向滴定后的溶液中加入2g Zn粉和5mL 2mol/L的H2SO4溶液,将Fe3+还原为Fe2+
步骤4:过滤,滤液用上述标准KMnO4溶液进行反应,消耗溶液10.00mL.
则样品中C2O42-的物质的量为__________;(写出计算过程);
(4)将一定量高锰酸钾溶液与酸化的草酸亚铁溶液混合,测得反应液中Mn2+的浓度随反应时间t的变化如图,其变化趋势的原因可能为__________;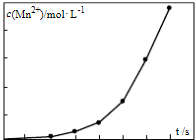
随着材料科学的发展,金属钒及其化合物得到了越来越广泛的应用,并被誉为“合金维生素”。工业上回收废钒催化剂(含有V2O5、VOSO4、K2SO4、SiO2)中钒的主要流程如下:
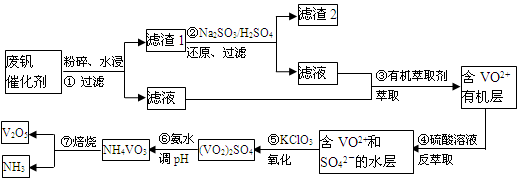
已知:(1)V2O5和NH4VO3均为难溶物,VOSO4和(VO2)2SO4均为易溶物。
(2) VO2++H2C2O4+H+ → VO2+ + CO2↑+ H2O
回答下列问题:
(1)步骤②的目的是 。
(2)步骤③的变化过程可简化为(HA表示有机萃取剂):
VOSO4 (水层)+ 2HA(有机层) VOA2(有机层)+ H2SO4(水层),则步骤④中可选择硫酸作反萃取的原因是 。
VOA2(有机层)+ H2SO4(水层),则步骤④中可选择硫酸作反萃取的原因是 。
(3)若ClO3-将被还原为Cl-,请写出骤⑤中发生反应的离子方程式为 。
(4)用硫酸酸化的H2C2O4溶液滴定(VO2)2SO4溶液,以测定操作⑤后溶液中含钒量的步骤为:取10.0mL0.1mol/LH2C2O4溶液于锥形瓶中,加入指标剂,将待测液盛放在滴定管中,滴定到终点时,消耗待测液的体积为10.00mL,由此可知(VO2)2SO4溶液钒元素的含量为 g/L。
(5)V2O5可用金属(如Ca、Al)热还原法获得钒,则金属铝热还原制得钒的化学方程式为 。
污染物的有效去除和资源的充分利用是化学造福人类的重要研究课题。某研究小组利用软锰矿(主要成分为MnO2,另含有少量铁、铝、铜、镍等金属化合物)作脱硫剂,通过如下流程既脱除燃煤尾气中的SO2,又制得电池材料MnO2(反应条件已省略).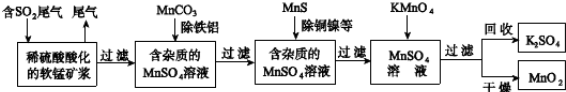
请回答下列问题:
(3)已知:25℃、101kPa时,
Mn(s)+O2(g)═MnO2(s)△H=-520kJ•mol-1
S(s)+O2(g)═SO2(g)△H=-297kJ•mol-1
Mn(s)+S(s)+2O2(g)═MnSO4(s)△H=-1065kJ•mol-1
SO2与MnO2反应生成无水MnSO4的热化学方程式是____________________________________。
(2)用离子方程式表示用MnCO3除去Al3+和Fe3+的原理(任选其一即可):_______________。
(3)用离子方程式表示用MnS除去Cu2+和Ni2+的原理(任选其一即可):___________________________。
(4)MnO2是碱性锌锰电池的正极材料.碱性锌锰电池放电时,正极的电极反应式是__________。
(5)MnO2可作超级电容器材料.用惰性电极电解MnSO4溶液可制得MnO2,其阳极的电极反应式是__________。
(6)假设脱硫的SO2只与软锰矿浆中MnO2反应.按照图示流程,将am3(标准状况)含SO2的体积分数为b%的尾气通入矿浆,若SO2的脱除率为89.6%,最终得到MnO2的质量为ckg,则除去铁、铝、铜、镍等杂质时,所引入的锰元素相当于MnO2____________kg。
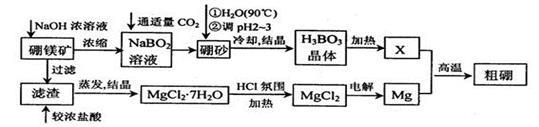
硼、镁及其化合物在工农业生产中应用广泛。
已知:硼镁矿主要成分为Mg2B2O5•H2O,硼砂的化学式为Na2B4O7•10H2O。利用硼镁矿制取金属镁及粗硼的工艺流程为:
回答下列有关问题:
(1)硼砂溶于热水后,常用H2SO4调pH2~3制取H3BO3,反应的离子方程式为 。X为H3BO3晶体加热脱水的产物,其与Mg制取粗硼的化学方程式为 。
(2)MgCl2·7H2O需要在HCl氛围中加热,其目的是 。若用惰性电极电解MgCl2溶液,其阴极反应式为 。
(3)镁-H2O2酸性燃料电池的反应机理为Mg+H2O2+2H+==Mg2++2H2O,则正极反应式为 。若起始电解质溶液pH=1,则pH=2时溶液中Mg2+离子浓度为 。已知Ksp[Mg(OH)2]=5.6 10-12,当溶液pH=6时 (填“有”或“没有”)Mg(OH)2沉淀析出。
10-12,当溶液pH=6时 (填“有”或“没有”)Mg(OH)2沉淀析出。
(4)制得的粗硼在一定条件下生成BI3,BI3加热分解可以得到纯净的单质硼。现将 0.020g粗硼制成的BI3完全分解,生成的I2用0.30mol·L-1Na2S2O3(H2S2O3为弱酸)溶液滴定至终点,消耗Na2S2O3溶液18.00mL。盛装Na2S2O3溶液的仪器应为 滴定管(填“酸式”或“碱式”)。该粗硼样品的纯度为 。(提示:I2+2S2O32-=2I-+S4O62-)
废旧显示屏玻璃种含有SiO2、Fe2O3、CeO2、FeO等物质。某课题小组以此玻璃粉末为原料,制得Ce(OH)4和硫酸铁铵矾[Fe2(SO4)3·(NH4)2SO4·24H2O],流程设计如下:
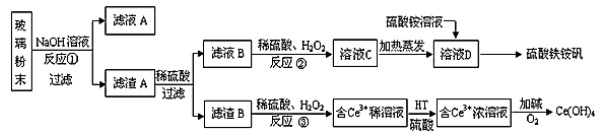
已知:Ⅰ.酸性条件洗,铈在水溶液中有Ce3+、Ce4+两种主要存在形式,Ce4+有较强氧化性;
Ⅱ.CeO2不溶于稀硫酸,也不溶于氢氧化钠溶液。
回答以下问题:
(1)反应②中过氧化氢的作用是 。
(2)反应③的离子方程式是 。
(3)已知有机物HT能将Ce3+从水溶液中萃取出来,该过程可表示为:
2 Ce3+(水层)+6HT(有机层) ≒2 CeT3 (有机层) +6H+(水层)
从平衡角度解释:向CeT3(有机层)加入硫酸获得较纯的含Ce3+的水溶液的原因是 。
(4)硫酸铁铵矾[Fe2(SO4)3·(NH4)2SO4·24H2O]广泛用于水的净化处理,其净水原理用离子方程式解释是 。
(5)相同物质的量浓度的以下三种溶液中,铵根离子浓度由大到小的顺序是 。
a.Fe2(SO4)3·(NH4)2SO4·24H2O b.(NH4)2SO4 c.(NH4)2CO3
(6)用滴定法测定制得的Ce(OH)4产品纯度。

若所用硫酸亚铁溶液在空气中露置一段时间后再进行滴定,则测得该Ce(OH)4产品的质量分数 。(填“偏大”、“偏小”或“无影响”);称取14.00g硫酸铁铵样品,将其溶于水配制成100mL溶液,分成两等份,向其中一份加入足量氢氧化钠溶液,过量洗涤沉淀并烘干灼烧至恒重得到1.60g固体;向另一份溶液中加入0.5mol/L硝酸钡溶液100mL,恰好完全反应。则该硫酸铁铵的化学式为 。
[化学—选修(二)化学与技术]常见锌锰干电池因含有汞、酸或碱等,废弃后进入环境将造成严重危害。某化学兴趣小组拟采用如下处理方法回收废电池中的各种资源。
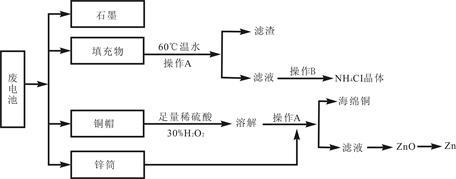
(1)填充物用60℃温水溶解,目的是 。
(2)操作A的名称为 。
(3)铜帽溶解时加入H2O2的目的是 (用化学方程式表示)。铜帽溶解完全后,可采用_________方法除去溶液中过量的H2O2。
(4)碱性锌锰干电池的电解质为KOH,总反应为Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2,其负极的电极反应式为 。
(5)滤渣的主要成分为含锰混合物,向含锰混合物中加入一定量的稀硫酸、稀草酸,并不断搅拌至无气泡为止。主要反应为 2MnO(OH)+MnO2+2H2C2O4+3H2SO4=3MnSO4+4CO2↑+6H2O。
①当1 mol MnO2参加反应时,共有 mol电子发生转移。
②MnO(OH)与浓盐酸在加热条件下也可发生反应,试写出该应的化学方程式: 。
(6)锌锰干电池所含的汞可用KMnO4溶液吸收。在不同pH下,KMnO4溶液对Hg的吸收率及主要产物如下图所示:

根据上图可知:
①pH对Hg吸收率的影响规律是随pH升高,汞的吸收率 。
②在强酸性环境下Hg的吸收率高的原因可能是KMnO4在酸性条件下 强。