某化工厂以软锰矿、闪锌矿(除主要成分为MnO2、ZnS外还含有少量的FeS、CuS、Al2O2等物质)为原料制取Zn和MnO2.
(1)在一定条件下,将这两种矿粉在硫酸溶液中相互作用,配平如下的化学方程式:

(2)将所得含有Mn2+、Fe3+、Cu2+、Al3+、Zn2+的酸性溶液按图1的工业流程进行处理得到溶液(Ⅳ)、电解溶液(Ⅳ)即得MnO2和Zn.

a.操作中①中加Zn粉后发生反应的离子方程式为: 、 .
b.操作②中加入MnO2的作用是 ;反应的离子方程式是 .
c.操作③中所加碳酸盐的化学式是 .
(3)电解法制备高锰酸钾的实验装置示意图(图中阳离子交换膜只允许K+离子通过):

①阳极的电极反应式为 .
②若电解开始时阳极区溶液为1.0L0.40mol/LK2MnO4溶液,电解一段时间后,溶液中 为6:5,阴极区生成生成KOH的质量为 .(计算结果保留3位有效数字)
为6:5,阴极区生成生成KOH的质量为 .(计算结果保留3位有效数字)
(4)已知25℃时,Ksp[Mg(OH)2]=5.6×10﹣12,Ksp[Cu(OH)2]=2.2×10﹣20,Ksp[Fe(OH)3]=4.0×10﹣38,Ksp[Al(OH)3]=1.1×10﹣33,
①在25℃下,向浓度均为0.1mol•L﹣1的AlCl3和CuCl2混合溶液中逐滴加入氨水,先生成 沉淀(填化学式)
②用MgCl2和AlCl3的混合溶液(A)与过量氨水(B)反应,为使Mg2+、Al3+同时生成沉淀,应先向沉淀反应器中加入 反应物.
③溶液中某离子物质的量浓度低于1.0×10﹣5mol•L﹣1时,可认为已沉淀完全.现向一定浓度的AlCl3和FeCl3的混合溶液中逐滴加入氨水,当Fe3+完全沉淀时,测定c(Al3+)=0.2mol•L﹣1.此时所得沉淀中 (填“还含有”或“不含有”)Al(OH)3.

 ,沸点
,沸点 ,在
,在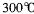 以上升华,易溶于水,也易溶于乙醚、丙酮等有机溶剂。据此判断GE3的晶体类型为________________。
以上升华,易溶于水,也易溶于乙醚、丙酮等有机溶剂。据此判断GE3的晶体类型为________________。 Fe(OH)2 + Ni(OH)2。
Fe(OH)2 + Ni(OH)2。 g M,则金属M的相对原子质量为 (用含“
g M,则金属M的相对原子质量为 (用含“ 粤公网安备 44130202000953号
粤公网安备 44130202000953号