关于非金属元素Si、N、S、Cl的叙述,正确的是 ( )
| A.通常情况下,它们的单质均为气体 | B.它们在自然界中都存在游离态 |
| C.它们都有对应的含氧酸 | D.每种元素都只有一种氧化物 |
原子序数由小到大排列的X、Y、Z三种短周期元素,已知三种元素的原子序数之和等于16,单质X2 、Y2 、Z2之间有如下转化关系(反应条件已略)。已知:甲、乙分子中均含有10个电子;丙分子中含有15个电子。请回答:
(1)Y2的电子式是___ ______;该分子中有 个σ键, 个π键。
(2)甲属于(填“极性”或“非极性”) 分子;晶体中甲分子的配位数为  。
。
(3)乙分子的VSEPR模型名称为 ,分子的立体构型名称为 。
(4)写出乙与Z2反应生成丙的化学方程式 。
(5)工业上用氧化铝、碳和乙在1400℃条件下反应,制取由元素Y和Al组成的化合物丁,同时还有CO和X2生成。已知反应中消耗1mol乙,可生成1.5molCO和1.5molX2。写出反应的化学方程式: ,氧化剂为 。
短 周期元素 W 、 X 、 Y 和 Z 在 周期表中的相对位置如 表 所示,这四种元素原子的最外层电子数之和为 21 。 下 列 关系正确 的 是( )
| A. |
氢化物沸点: |
B. |
氧化物对应水化物的酸性: |
| C. |
化合物熔点: · |
D. |
简单离子的半径: |
下列说法不正确的是( )
| A.活性炭、SO2、Na2O2都能使品红溶液褪色,但原理不同 |
| B.同温同压下,两份相同质量的铁粉,分别与足量的稀硫酸和稀硝酸反应,产生气体的体积不相等 |
| C.将SO2气体通入BaCl2溶液中至饱和,未见沉淀生成,继续通入NO2则有沉淀生成 |
| D.将足量Cl2通入NaBr、NaI的混合溶液中,反应后将溶液蒸干并充分灼烧,剩余的固体物质成分为NaCl |
①在实验室里,要证明钠、镁、铝的金属性依次减弱的实验,除钠、镁、铝以外,还需的试剂为_________________________。
②在实验室里,要做证明Cl、Br、I的非金属性依次减弱的实验,所需的试剂除:NaCl溶液,NaBr溶液,KI溶液外,还需要的试剂为____________________。
反应的离子方程式为:_______________________________________________________
__________ ______________ __________________
________ ____
不论以何种比例混合,将甲和乙两种混合气体同时通入过量的丙溶液中,一定能产生沉淀的组合是
| 序号 |
甲 |
乙 |
丙 |
| ① |
CO2 |
SO2 |
石灰水 |
| ② |
HCl |
CO2 |
石灰水 |
| ③ |
CO2 |
SO2 |
Ba(NO3)2 |
| ④ |
NO2 |
SO2 |
BaCl2: |
| ⑤ |
CO2 |
NH3 |
CaCl2 |
A.②③④ B.②③④⑤ C①③④ D.①②③④
碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列有关说法正确的是
| A.洗气瓶中产生的沉淀是碳酸钡 |
| B.在Z导管出来的气体中无二氧化碳 |
| C.洗气瓶中产生的沉淀是硫酸钡 |
| D.在Z导管口有红棕色气体出现 |
盐酸、硫酸和硝酸都是重要的化工原料,也是化学实验室里必备的重要试剂。请回答下列问题: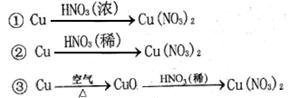
(1) 常温下,可用铁、铝制的容器盛放浓硫酸,说明浓硫酸具有 性,用玻璃棒蘸取浓硫酸滴在纸上,纸逐渐变黑,说明浓硫酸具有 性,实验室不能用浓硫酸干燥氨气,说明硫酸具有 性。
(2) 硝酸铜是制备Cu-Zn-Al系催化剂的重要原料,工业上用洗净的废铜屑作原料来制备硝酸铜。右图所示制备方法符合“绿色化学”思想的
是 (填序号)。
(3) ①在100ml 18 mol/L浓硫酸中加入过量铜片,加热使之充分反应,产生的气体在标准状况下的体积可能是 。
| A.40.32 L | B.30.24 L | C.20.16 L | D.13.44 L |
②若使上述反应中剩余的铜片继续溶解,可向其中加入硝酸钠,写出反应的离子方程式 。
(4) 某同学向浸泡铜片的稀盐酸中加入H2O2后,铜片溶解,并且该反应的产物只有氯化铜和水,则反应的化学方程式为 。
A、B、C、D均为中学常见物质且均含有同一种元素,它们之间的部分转化关系如下图
所示(反应条件已经略去): 。以下推断不正确的是( )
。以下推断不正确的是( )
A.若A为溶于CS2的淡黄色固体单质,且D为强酸,则B通常用品红试剂来检验。
B.若A为喷泉实验常用的气体且其水溶液呈碱性,则D能与A反应制化肥
C.若C为温室气体,则A与C在一定条件下反应可生成B
D.若B、C对环境造成的危害主要是光化学烟雾等,则A不可能是单质
(10)[物质结构].甲、乙、丙、丁为前三周期元素形成的微粒,它们的电子总数相等。已知甲、乙、丙为双原子分子或负二价双原子阴离子,丁为原子。
(1)丙与钙离子组成的离子化合物跟水反应产生一种可燃性气体,反应的化学程式是 ___________________________________
(2)乙在高温时是一种还原剂,请用化学方程式表示它在工业上的一种重要用途:___________________________________
(3)在一定条件下,甲与O2反应的化学方程式是 _______________________
(4)丁的元素符号是_________,它的核外电子排布式为 _______________________
(5)丁的氧化物的晶体结构与_________________ 的晶体结构相似。
在常温常压下,a,b,c,d四支相同的试管中,分别装入以等物质的量混合的两种气体。a试管内是NO2和O2,b试管内是C12和SO2,c试管内是NO和O2,d试管内是O2和H2。将四支试管迅速同时倒立于水中,最终水面上升高度h的比较,正确的是
| A.hb>hc>ha>hd | B.hc>ha>hb>hd |
| C.hd>ha>hc>vhb | D.hb>ha>hc>hd |
已知某物质X能发生如下转化:
下列有关上述转化关系中物质及其反应的叙述错误的是
| A.若X为N2或NH3,则A为硝酸 |
| B.若X为S或H2S,则A为硫酸 |
| C.若X为非金属单质或非金属氢化物,则A不一定能与金属铜反应生成Y |
| D.反应①和②一定为氧化还原反应,反应③一定为非氧化还原反应 |
盐酸、硫酸和硝酸都是重要的化工原料,也是化学实验室里必备的重要试剂。请回答下列问题:
(1)常温下,可用铁、铝制的容器盛放浓硫酸,说明浓硫酸具有_______性。用玻璃棒蘸取浓硫酸滴在纸上,纸逐渐变黑,说明浓硫酸具有_______性。
(2)硝酸铜是制备Cu-Zn-Al系催化剂的重要原料,工业上用洗净的废铜屑作原料来制备硝酸铜。下列制备方法符合“绿色化学”思想的是_______ (填序号)。
①Cu+HNO3(浓) Cu(NO3)2
Cu(NO3)2
②Cu+HNO3(稀) Cu(NO3)2
Cu(NO3)2
③
(3)①在100 mL 18 mol/L浓硫酸中加入过量铜片,加热使之充分反应,产生的气体在标准状况下的体积可能是_______
| A.40.32 L | B.30.24 L | C.20.16 L | D.13.44 L |
②若使上述反应中剩余的铜片继续溶解,可向其中加入硝酸钠,写出反应的离子方程式______________________________。
(4)某同学向浸泡铜片的稀盐酸中加入H2O2后,铜片溶解,并且该反应的产物只有氯化铜和水。该反应的化学方程式为__________________________________________。
为了探究三种气态氧化物(SO2、NO2、CO2)的性质,某同学设计了一组实验:
实验一:探究三种气体在水中的溶解性,用三支相同的试管收集满三种气体,倒置在盛满水的烧杯中,一段时间后,观察到的现象如图A、B、C所示。
(1)在相同条件下,三种气体在水中溶解度最大的是________(写化学式)写出A烧杯中发生反应的化学方程式:____ 。如果在三只烧杯中分别滴几滴紫色石蕊试液,可观察到的现象是_____________________ 。
实验二:用三只集气瓶收集满二氧化硫、二氧化氮气体,然后将其倒置在水槽中。分别缓慢通入适量O2或Cl2,如图D、E、F所示。一段时间后,D、E装置的集气瓶中充满溶液,F装置的集气瓶中还有气体剩余。
(2)实验二中装置D的集气瓶最终充满溶液(假设瓶内液体不扩散):
①写出装置D中总反应的化学方程式:
_______________________________________________。
②假设该实验条件下,气体摩尔体积为a L·mol-1。则装置D的集气瓶中所得溶液溶质的物质的量浓度为____________________。
(3) 写出实验F通入氧气后,发生反应的化学方程式:____________________________。
(4)溶液充满集气瓶后,在E装置的水槽里滴加硝酸钡溶液,可能观察到的现象为________,用有关的离子方程式解释原因:________________________。