现有:①HNO3 ②SiO2 ③CaCO3 ④C2H5OH ⑤CuSO4 ⑥FeCl3。请你根据所学知识,选择恰当的序号填空:
(1)水溶液呈蓝色的是 ;
(2)制造玻璃和水泥都需要的原料是 ;
(3)能溶于水但不属于电解质 的是 。
的是 。
工业上制取CuCl2的生产流程如下:
请结合下表数据,回答下列问题:
| 物 质 |
Fe(OH)2 |
Cu(OH)2 |
Fe(OH)3 |
| 完全沉淀时的pH范围 |
≥9.6 |
≥6.4 |
3~4 |
⑴ 溶液A中加入NaClO的目的是 ;
此反应离子方程式为 ;
⑵ 在溶液B中加入CuO的作用是 ;
⑶ 操作a的目的是 ;
⑷ 在Cu(OH)2加入盐酸使Cu(OH)2转变为CuCl2。采用多量盐酸和低温蒸干的目的是 。
臭氧层是地球生命的保护神,臭氧比氧气具有更强的氧化性。实验室可将氧气通过高压放电管来制取臭氧:
(1)在一定条件下,有aL氧气和臭氧的混合气体,当其中的臭氧完全转化为氧气,体积变为1.2aL,原混合气体中氧气的质量分数为 。
(2)若在标况下,在臭氧发生器中装入100mL氧气,最后体积为95mL。最终状态时混合气体的密度是 g/L。(保留一位小数)
(3)实验室将氧气和臭氧的混合气体0.896L(标准状况)通入盛有20.0g铜粉的反应 器中,充分加热后,粉末的质量变为21.6g。原混合气中臭氧的体积分数为__________________。
器中,充分加热后,粉末的质量变为21.6g。原混合气中臭氧的体积分数为__________________。
(10)[物质结构].甲、乙、丙、丁为前三周期元素形成的微粒,它们的电子总数相等。已知甲、乙、丙为双原子分子或负二价双原子阴离子,丁为原子。
(1)丙与钙离子组成的离子化合物跟水反应产生一种可燃性气体,反应的化学程式是 ___________________________________
(2)乙在高温时是一种还原剂,请用化学方程式表示它在工业上的一种重要用途:___________________________________
(3)在一定条件下,甲与O2反应的化学方程式是 _______________________
(4)丁的元素符号是_________,它的核外电子排布式为 _______________________
(5)丁的氧化物的晶体结构与_________________ 的晶体结构相似。
现向含6 mol KI的硫酸溶液中逐滴加入KBrO3溶液,整个过程中含碘物质的物质的量与所加入KBrO3的物质的量的关系如图所示。已知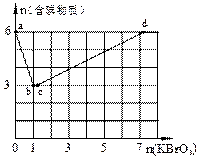
①BrO3-+6I一+6H+=3I2+Br-+3H2O;
②2BrO3- +I2 = 2IO3- + Br2;
请回答下列问题:
(1)b点时,KI反应完全,则消耗的氧化剂与还原剂物质的量之比为 ,还原产物是 。
(2)b→c过程中只有一种元素的化合价发生变化,写出该过程的离子反应方程式 。
(3)由反应②有同学由此得出氧化性:I2>Br2的结论,你认为是否正确,并说明理由
。
(4)含6 mol KI的硫酸溶液所能消耗n(KBrO3)的最大值
为 。
(5)加碘食盐中含有碘酸钾(KIO3),现以电解法制备碘酸钾,实验装置如图所示。先将一定量的碘溶于过量氢氧化钾溶液,发生反应:3I2+6KOH=5KI+KIO3+3H2O,将该溶液加入阳极区,另将氢氧化钾溶液加入阴极区,开始电解。阳极的电极反应式为 ;阴极观察到的现象是 ;
A、B、C、D四种元素的核电荷数均小于18,A元素原子核外只有1 个电子;B是地壳中含量最多的元素;B、C可形成两种化合物CB和CB2,C的最高正价与最低负价绝对值相等,CB有毒,CB2可用于灭火,D+具有与Ne原子相同的电子层结构。
个电子;B是地壳中含量最多的元素;B、C可形成两种化合物CB和CB2,C的最高正价与最低负价绝对值相等,CB有毒,CB2可用于灭火,D+具有与Ne原子相同的电子层结构。
(1)试判断A、B、C、D四种元素的名称。
A__________,B______________, C___________,D 。
(2)由A、B、D三种元素 组成的化合物的电子式为
组成的化合物的电子式为  ,
,
其所包含的具体化学键型为 。
(3)用电子式表示A2B的形成过程 。
(4)如上图所示,在烧瓶中收集满CB2气体,用带导管(导管一端事先绑好一个气球)的胶塞塞紧,当打开胶塞迅速倒入浓的A、B、D三种元素组成的化合物的溶液后,立即塞紧胶塞振荡,可观察到气球膨胀的现象,请用离子方程式解释其原因:
(15分)
沿海地区有着丰富的海水资源,海水占地球总储水量的97.4﹪,海水是人类宝贵的自然资源,若把海水淡化和化工生产结合起来,既可以解决淡水资源缺乏的问题,又可以充分利用海水资源,从海水中可以提取多种化工原料,下图是某工厂对海水资源综合利用的示意图:
⑴请列举海水淡化的两种方法 、 。
⑵使用离子交换树脂与水中的离子进行交换也是常用的水处理技术。聚丙烯酸钠是一种离子交换树脂,写出聚丙烯酸钠单体的结构简式 .
⑶步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br -,其目的是: .
步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式
⑷在制取无水氯化镁时需要在干躁的HCl气流中加热MgCl2.6H2O的原因
.
⑸电解无水氯化镁所得的镁蒸气在特定的环境里冷却后即为固体镁,下列物质中可以用做镁蒸气的冷却剂的是
| A.H2 | B.CO2 | C.空气 | D.O2 E.水蒸气 |
⑹苦卤(海水蒸发结晶分离出食盐后的母液)中含有较多的NaCl、MgCl2、KCl、MgSO4等物质.用沉淀法测定苦卤中MgCl2的含量(g/L),测定过程中应获取的数据有
.
原子序数由小到大排列的X、Y、Z三种短周期元素,已知三种元素的原子序数之和等于16,单质X2 、Y2 、Z2之间有如下转化关系(反应条件已略)。已知:甲、乙分子中均含有10个电子;丙分子中含有15个电子。请回答:
(1)Y2的电子式是___ ______;该分子中有 个σ键, 个π键。
(2)甲属于(填“极性”或“非极性”) 分子;晶体中甲分子的配位数为  。
。
(3)乙分子的VSEPR模型名称为 ,分子的立体构型名称为 。
(4)写出乙与Z2反应生成丙的化学方程式 。
(5)工业上用氧化铝、碳和乙在1400℃条件下反应,制取由元素Y和Al组成的化合物丁,同时还有CO和X2生成。已知反应中消耗1mol乙,可生成1.5molCO和1.5molX2。写出反应的化学方程式: ,氧化剂为 。
、现有下列5种气体:Cl2、CO2、SO2、NO2、NH3。试回答下列问题:
(1)超市商品琳琅满目,但摆放和布置都清晰有序,这是因为事先进行了分类处理。
对物质进行分类是我们学习和研究化学时常用的方法,采用不同的分类标准,可以对同一组物质进行不同的分类,请你填写下表:
| |
A组 |
B组 |
C组 |
D组 |
| 分类标准 |
易溶于水 |
|
有毒气体 |
|
| 不属于该类别的物质 |
|
Cl2、NO2 |
|
Cl2 |
(2)Cl2是一种有毒的物质,如果发生Cl2泄漏,你将采取怎样的措施?(写一条即可)
(3)管道工人曾经用浓氨水检验氯气管道是否漏气,已知能发生如下反应(在有水蒸气存在的条件下):2NH3+3Cl2=6HCl+N2,如果氯气管道某处漏气,用该方法检查时会出现的现象是_______________________
A—J是中学化学中常见的几种物质,它们之间的转化关系如图所示。已知常温下A为固体单质,B为淡黄色粉末,C、F、I为气态单质,E在常温下为液体,且E可由C、F合成,J可用作杀菌消毒剂。
回答下列问题:
(1)B的化学式: ,E的电子式_________。
(2)写出反应⑦的离子方程式 __________________________。
(3)向AlCl3溶液中加入少量固体B,写出反应的化学方程式_____________________。
(4)以Pt为电极电解滴加有少量酚酞的H饱和溶液,则在_____________(填“阴、阳”)极附近溶液由无色变为红色,其原因是_________________ 。
(4分)古希腊流传这样一个传奇故事:一批贩运纯碱的商船停泊在江边的沙岸部,商人们找不到石头来搭灶煮饭,就把船上的大块纯碱搬来,放在沙地上垫锅做饭,饭熟后商人们惊奇地发现“灶”变成了晶莹透明的固体。你认为这种固体可能是____________,其主要成分是________________________。
运用化学反应原理研究常见元素的单质及其化合物有重要意义。
(1)合成氨反应N2 (g)+3H2(g)  2NH3(g),△H<0。若在恒温、恒压条件下向平衡体系中通入氩气,则平衡 移动(填“向左”“向右”或“不”);使用催化剂,上述反应的△H________(填“增大” “减小” 或“不变”)。
2NH3(g),△H<0。若在恒温、恒压条件下向平衡体系中通入氩气,则平衡 移动(填“向左”“向右”或“不”);使用催化剂,上述反应的△H________(填“增大” “减小” 或“不变”)。
(2)向Na2C2O4溶液加入少量石蕊,溶液显 色,请用离子方程式表示出现该现象的原因: ;
(3)pH相同的氨水和氢氧化钠,分别用蒸馏水稀释至原来溶液的100倍,则稀释后两种溶液的pH分别为m和n,则m n(选填“>”“<”“=”);
(4)有人设想寻求合适的催化剂和电极材料,以N2、H2为电极反应物,以HCl―NH4Cl为电解质溶液制造新型燃料电池。请写出该电池的正极反应式 。
(5)氢气燃烧热值高。实验测得,在常温常压下,4gH2完全燃烧生成液态水,放出571.6kJ热量,则表示H2燃烧热的热化学方程式为 。
(6)某温度(t℃)时,测得0.01mol・L-1的NaOH溶液的pH=11。在此温度下,将pH=a的H2SO4溶液VaL与pH=b的NaOH溶液VbL混合,若所得混合液为中性,且a+b=12,则Va∶Vb= 。
A、C、E是中学化学中常见的单质,A是固体,C、E是无色无味的气体,D是黑色晶体,它们之间的转化关系如下图所示。
(1)写出A、B、C的化学式:
A___________________;B_________________;C______________。
(2)写出A、B转化为D、E的化学方程式_____________________________________。
(3)写出A与足量稀硝酸反应的离子方程式___________________________________。
工业合成氨与制备硝酸一般可连续生产,流程如下:
(1)工业生产时,制取氢气的一个反应为:CO+H2O(g) CO2+H2
CO2+H2
①t℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气。反应建立平衡后,体系中c(H2)=0.12mol·L-1。该温度下此反应的平衡常数K=_____(填计算结果)。
②保持温度不变,向上述平衡体系中再加入0.1molCO,当反应重新建立平衡时,水蒸气的转化率α(H2O)=________。
(2)合成塔中发生反应N2(g)+3H2(g) 2NH3(g);△H<0。下表为不同温度下该反应的平衡常数。由此可推知,表中
2NH3(g);△H<0。下表为不同温度下该反应的平衡常数。由此可推知,表中
| T/K |
T1 |
573 |
T2 |
| K |
1.00×107 |
2.45×105 |
1.88×103 |
T1____573K(填“>”、“<”或“=”)。 (3)NH3和O2在铂系催化剂作用下从145℃就开始反应:
(3)NH3和O2在铂系催化剂作用下从145℃就开始反应:
4NH3(g)+5O2(g) 4NO(g)+6H2O(g) △H=-905kJ·mol-1
4NO(g)+6H2O(g) △H=-905kJ·mol-1
不同温度下NO产率如图所示。温度高于900℃时,
NO产率下降的原因 。
(4)吸收塔中发生反应的化学方程式为:
。
(5)上述工业流程中,采用了循环操作工艺的是 (填序号)
(6)硝酸厂的尾气含有氮氧化物,如果不经处理直接排放将污染空气。目前科学家探索利用燃料气体中的甲烷等将氮氧化物还原为氮气和水,其反应机理为:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g); △H=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g); △H=-1160kJ·mol-1
则甲烷直接将NO2还原为N2的热化学方程式为:_____________________________。
(12 分)卤素化学丰富多彩,能形成卤化物、卤素互化物、多卤化物等多种类型的化合物。
(1)基态溴原子的电子排布式为 。
(2)卤素互化物如BrI、ICl等与卤素单质结构相似、性质相近。Cl2、BrI、ICl沸点由高到低的顺序为 。
(3)多卤化物RbICl2加热时会分解为晶格能相对较大的卤化物A和卤素互化物或卤素单质,A的化学式为 。
(4)I3+属于多卤素阳离子,根据VSEPR模型推测I3+的空间构型为 。
(5)气态氟化氢中存在二聚分子(HF)2,这是由于 。
(6)①HClO4、②HIO4、③H5IO6[可写成(HO)5IO]的酸性由强到弱的顺序为 (填序号)。