有一种广泛用于汽车、家电产品上的高分子涂料,是按下列流程图生产的。流程图中:A和M(C3H4O)都可发生银镜反应,M和N的分子中碳原子数相同,A的烃基上的一氯代物有3种。
(1)写出下述物质的结构简式:A____________________,M___________。
(2)物质A的同类别的同分异构体的结构简式为________________________。
(3)N+B―→D的化学方程式为_________
(4)反应类型:X为________,Y为_____。
(5)N在一定条件下可以与水反应生成H,H中没有甲基。H也可以生成高分子化合物,写出生成该高分子化合物的化学方程式
煤制油是一项新兴的、科技含量较高的煤化工技术,发展煤制油对我国而言具有重大意义。下列是煤通过间接液化技术制汽油和丙烯的主要工艺流程图。
已知甲醇制烃的反应原理为:
(1)为了提高原料利用率,上述工艺中应控制合成气中V(CO):V(H2)= 。
(2)由二甲醚在催化剂作用下转化为丙烯的化学方程式为: 。
(3)每生产1t甲醇约耗煤1.5t,每生产1 t汽油约需耗2.4t甲醇,2015年我国煤制油将达到1000万吨,则2015年当年需消耗原煤约 万吨。
(4)采用MTG法生产的汽油中,均四甲苯(1,2,4,5-四甲基苯)质量分数约占4 %~7%,均四甲苯的结构简式为: 。
(5)采用DMTO技术,若获得乙烯和丙烯及丁烯3种烃,生成丁烯的选择性(转化丁烯的甲醇的物质的量与甲醇总物质的量之比)为20%,其余生成乙烯和丙烯,设丙烯的选择性为x,今有403.2L(标准状况)合成气,且完全转化为甲醇,甲醇转化为烯烃的总转化率亦为100%,请作出丙烯的物质的量随x变化的曲线。
在恒温恒容的密闭容器中,发生反应3A(g)+B(g) xC(g)。
xC(g)。
Ⅰ、将3molA和2molB在一定条件下反应,达平衡时C的体积分数为a;
Ⅱ、若起始时A、B、C投入的物质的量分别为n(A)、n(B)、n(C),平衡时C的体积分数也为a。
下列说法正确的是
A、若Ⅰ达平衡时,A、B、C各增加1mol,则B的转化率将一定增大
B、若向Ⅰ平衡体系中再加入3molA和2molB,C的体积分数若大于a,可断定x>4
C、若x=2,则Ⅱ体系起始物质的量应当满足3 n(B) =n(A)+3
D、若Ⅱ体系起始物质的量当满足3 n(C) +8n(A)="=12" n(B)时,可断定x=4
有甲、乙、丙三种物质:


甲 乙 丙
(1)乙中含有的官能团的名称为____________________。
(2)由甲转化为乙需经下列过程(已略去各步反应的无关产物,下同):
其中反应I的反应类型是_________,反应II的条件是_______________,反应III的化学方程式为__________________________________(不需注明反应条件)。
(3)由甲出发合成丙的路线之一如下:
(a)下列物质不能与B反应的是 (选填序号)。
a.金属钠 b.FeCl3 c.碳酸钠溶液 d.HBr
(b)C的结构简式为___________;丙的结构简式为 。
(c)D符合下列条件的所有同分异构体 种,任写其中一种能同时满足下列条件的异构体结构简式 。
a.苯环上的一氯代物有两种
b.遇FeCl3溶液发生显色反应
c.能与Br2/CCl4发生加成反应
某二元酸(H2A)按下式发生电离:H2A=H++HA-;HA-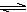 H++A2-。现有下列四种溶液:
H++A2-。现有下列四种溶液:
① 0.01mol・L1的H2A溶液
② 0.01mol・L1的NaHA溶液
③ 0.02mol・L1的HCl溶液与0.04mol・L1的NaHA溶液等体积混合
④ 0.02mol・L1的NaOH溶液与0.02mol・L1的NaHA溶液等体积混合
下列关于上述四种溶液的说法正确的是( )
A.溶液②中存在水解平衡:HA―+H2O 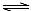 H2A+OH―
H2A+OH―
B.溶液③中有:c(HA-)+2c(A2-)=c(Na+)
C.溶液④中有:c(OH-)=c(H+)+c(HA-)
D.四种溶液中c (HA-)浓度大小:③>①>②>④
A、B、C、D、E、F、G均是原子序数小于36的元素。A的基态原子外围电子排布式为3s2;B原子的L电子层的P能级上有一个空轨道; C元素的基态原子最外层有3个未成对电子,次外层有2个电子; D 的原子的2p轨道上有1个电子的自旋方向与其它电子的自旋方向相反;E是海水中除氢、氧元素外含量最多的元素;F和G在周期表中既处于同一周期又位于同一族,且原子序数F比G小2。
根据信息回答下列问题:
(1)C的外围电子排布图为 。C与氢元素可分别形成含10个电子的分子、阴离子和阳离子,阳离子中中心原子的杂化类型为 ;
(2)用电子式表示化合物AE2的形成过程 。
(3)F与BD易形成配合物F(BD)5,在F(BD)5中F的化合价为_______;与BD分子互为等电子体的离子的化学式为 。
(4)E有多种含氧酸根①EO- ②EO2- ③EO3- ④EO4-,其中空间构型为四面体型的是 。(填序号)
(5)B、C、D、E原子两两相互化合形成的分子有多种,请列举一种分子内所有原子都满足最外层8电子稳定结构的分子:_________(写分子式)
(6) G的价电子排布式为 。GD晶体晶胞结构为NaCl型, 晶胞边长为428 pm。
晶胞中两个G原子之间的最短距离为___________m(精确至0.01)。由于晶体缺陷,晶体的化学式为 G0.88D,若晶体中的G分别为G2﹢、G3﹢,此晶体中G2﹢与G3﹢的最简整数比为_________。
某相对分子质量为26的烃A,是一种重要的有机化工原料,以A为原料在不同的反应条件下可以转化为烃B、烃C。B、C的核磁共振谱显示都只有一种氢,B分子中碳碳键的键长有两种。以C为原料通过下列方案可以制备具有光谱高效食品防腐作用的有机物M,M分子的球棍模型如图所示。
⑴B能使溴的四氯化碳溶液褪色,则B的结构简式为 ,B与等物质的量Br2作用时可能有 种产物。
⑵C→D的反应类型为 ,M的分子式为 。
⑶写出E→F的化学方程式 。
⑷G中的含氧官能团的名称是 ,写出由G反应生成高分子的化学反应方程式: 。
⑸M的同分异构体有多种,写出四种满足以下条件的同分异构体的结构简式:
①能发生银镜反应 ②含有苯环且苯环上一氯取代物有两种
③遇FeCl3溶液不显紫色 ④1mol该有机物与足量的钠反应生成1mol氢气
(提示:一个碳原子上同时连接两个-OH的结构不稳定)
、 、 、 。
纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:
| 方法Ⅰ |
用炭粉在高温条件下还原CuO |
| 方法Ⅱ |
电解法,反应为2Cu + H2O  Cu2O + H2↑。 Cu2O + H2↑。 |
| 方法Ⅲ |
用肼(N2H4)还原新制Cu(OH)2 |
(1)工业上常用方法Ⅱ和方法Ⅲ制取Cu2O而很少用方法Ⅰ,其原因是 。
(2)已知:2Cu(s)+1/2O2(g)=Cu2O(s) △H = -akJ·mol-1
C(s)+1/2O2(g)=CO(g) △H = -bkJ·mol-1
Cu(s)+1/2O2(g)=CuO(s) △H = -ckJ·mol-1
则方法Ⅰ发生的反应:2CuO(s)+C(s)= Cu2O(s)+CO(g);△H = kJ·mol-1。
(3)方法Ⅱ采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示,该电池的阳极反应式为 。
(4)方法Ⅲ为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2。该制法的化学方程式为 。
(5)在相同的密闭容器中,用以上两种方法制得的Cu2O分别进行催化分解水的实验: △H >0
△H >0
水蒸气的浓度随时间t变化如下表所示。
| 序号 |
|
0 |
10 |
20 |
30 |
40 |
50 |
| ① |
T1 |
0.050 |
0.0492 |
0.0486 |
0.0482 |
0.0480 |
0.0480 |
| ② |
T1 |
0.050 |
0.0488 |
0.0484 |
0.0480 |
0.0480 |
0.0480 |
| ③ |
T2 |
0.10 |
0.094 |
0.090 |
0.090 |
0.090 |
0.090 |
下列叙述正确的是 (填字母代号)。
A.实验的温度:T2<T1
B.实验①前20 min的平均反应速率 v(O2)=7×10-5 mol·L-1 min-1
C.实验②比实验①所用的催化剂催化效率高
某废金属屑中主要成分为Cu、Fe、Al,还含有少量的铜锈[Cu2(OH)2CO3]、少量的铁锈和少量的氧化铝,用上述废金属屑制取胆矾(CuSO4·5H2O)、无水AlCl3和铁红的过程如下图所示:
(1)在废金属屑粉末中加入试剂A,生成气体1的反应的离子方程式是 。
(2)溶液2中含有的金属阳离子是 ;气体2的成分是 。
(3)溶液2转化为固体3的反应的离子方程式是 。
(4)固体2制取CuSO4溶液有多种。 如在固体2中加入稀H2SO4后,通入O2并加热,使固体2全部溶解得CuSO4溶液,反应的离子方程式是 。
(5)溶液1转化为溶液4的一系列过程,不能简化为“向溶液1中+加试剂C→溶液4”,理由是 。
(6)直接加热AlCl3·6H2O不能得到无水AlCl3。SOCl2为无色液体,极易与水反应生成HCl和一种具有漂白性的气体。AlCl3·6H2O与SOCl2混合加热制取无水AlCl3,反应的化学方程式是 。
某校化学学习小组拟验证NO能被氨气还原并测定其转化率,设计如下实验:
参考知识:NO气体与FeSO4溶液反应生成可溶性硫酸亚硝基合铁(+2价):NO+FeSO4=Fe(NO)SO4
试回答下列问题:
⑴ 可用上图中装置 (填编号,多选)进行氨气的实验室制备。
D装置可用于下列 (填编号,多选)气体的制备。
a CO2 b O2 c SO2 d C2H4 e C2H2 f H2
⑵ 装置③、④若用同一装置,则该装置中所盛装的药品是 (填编号)
| A.氯化钙 | B.浓硫酸 | C.五氧化二磷 | D.碱石灰 |
⑶ 装置⑥中,粗玻璃管X的作用 ,装置⑦的作用
⑷ 装置⑥的广口瓶中,除生成Fe(NO)SO4外,还有白色沉淀生成,写出生成该沉淀的离子方程式
⑸ 当进入装置⑤的NO为2.688L(标准状况,下同),氨气过量,最后收集到2.016LN2,则NO的转化率为 。
黄酮醋酸(F)具有独特抗癌活性,它的合成路线如下:

已知:RCN在酸性条件下发生水解反应:
写出A转化为B的化学方程式_______________。
F分子中有3个含氧官能团,名称分别为醚键、___________和_____________。
E在酸性条件下水解的产物可通过缩聚反应生成高分子化合物,该高分子化合物的结构简式为______________________。
写出符合下列条件的D的两种同分异构体的结构简式___________________。
①分子中有4种化学环境不同的氢原子
②可发生水解反应,且一种水解产物含有酚羟基,另一种水解产物含有醛基。
对羟基苯乙酸乙酯( )是一种重要的医药中间体。写出以A和乙醇为主要原料制备对羟基苯乙酸乙酯的合成路线流程图(无机试剂任选)。
)是一种重要的医药中间体。写出以A和乙醇为主要原料制备对羟基苯乙酸乙酯的合成路线流程图(无机试剂任选)。
甲酸甲酯水解反应方程式为:HCOOCH3 + H2O  HCOOH + CH3OH – Q(Q>0)
HCOOH + CH3OH – Q(Q>0)
某小组通过实验研究该反应(反应过程中体积变化忽略不计)。反应体系中各组分的起始量如左下表。甲酸甲酯转化率在温度T1下随反应时间(t)的变化如右下图:
| 组分 |
物质的量/mol |
| HCOOCH3 |
1.00 |
| H2O |
1.99 |
| HCOOH |
0.01 |
| CH3OH |
0.52 |

上述反应的平衡常数表达式为K=_______________________。
计算15~20min范围内:甲酸甲酯的减少量为 mol,甲酸甲酯的平均反应速率为 mol/min;80~90min范围内甲酸甲酯的平均反应速率为___________ mol/min。
依据以上数据,推断该反应在10min后反应速率迅速加快的原因: 。
其他条件不变,提高温度为T2,在答题卡框图中画出温度T2下甲酸甲酯转化率随反应时间变化的预期结果示意图。
常温下,0.1 mol/L氨水溶液中 =1×10-8,下列叙述错误的是
=1×10-8,下列叙述错误的是
| A.该溶液中氢离子的浓度:c(H+ ) = 1×10-9 mol/L |
| B.0.1 mol/L氨水溶液与0.1 mol/L HCl溶液等体积混合后所得溶液中: c(NH4+ ) + c(H+ ) = c(Cl- ) + c(OH-) |
| C.0.1 mol/L的氨水溶液与0.05 mol/L H2SO4溶液等体积混合后所得溶液中: c(NH4+ ) + c(NH3) + c(NH3·H2O) = 2c(SO42-) |
| D.浓度均为0.1 mol/L的NH3·H2O和NH4Cl溶液等体积混合后,若溶液呈碱性,则 |
c(NH4+ )> c(NH3·H2O) > c(Cl-) > c(OH-) > c(H+ )
[化学一基础有机化学]下列是某有机物合成反应的流程图:
已知甲溶液遇石蕊溶液变红。请回答下列问题:
(1)③的反应类型是________,目标产物中官能团的名称是__________;丙的分子式为_________。
(2)写出生成甲的化学方程式________________________________。
(3) →丙实际需要两步才能完成,写出第一步反应的化学方程式________
→丙实际需要两步才能完成,写出第一步反应的化学方程式________
_______________,第二步所用试剂及目的是________________________,
(4)丙有多种同分异构体,其中符合下列条件的同分异构体共有______种,写出其中核磁共振氢谱有6种峰的物质的结构简式_____________________________。
①遇FeCl3溶液呈紫色;②能发生银镜反应及水解反应;③苯环上只有2个取代基
[化学一化学与技术]
金属钛(Ti)因为具有许多神奇的性能越来越引起人们的关注,被誉为“未来金属”。常温下钛不和非金属、强酸反应,加热至红热时,能与常见的非金属反应。工业上由钒钛磁铁矿经“选矿”得到的钛铁矿(主要成分为FeTiO3)制取金属钛的主要工艺过程如下:
(1)从金属矿石中提炼金属一般需要经过三个阶段,上述工艺溶度积中涉及的有矿石中金属元素的还原、矿石的富集、金属的精炼;没有涉及的一个阶段是______________;生铁实际上属于铁______等元素形成的合金。若生产中碳的氧化产物主要为一种可燃性气体,请写出反应②的化学方程式__________________________。
(2)生产中碳除了用还原剂还原还原金属矿物外,还有一个重要作用是______________;反应③是在氩气的环境中进行,目的是_____________________,如何从反应③后的固体中获得金属钛_______________________________。
(3)已知在氯化过程中还有一种副产物VOCl3生成,实际生产中常在409K时用铜还原VOCl3,得到不溶于TiCl4的VOCl2,当有1molCu参加反应时转移的电子数为NA,试写出该反应的化学方程式为___________________。