现有A、B、C、D四种短周期元素, A分别与B、C、D结合生成甲、乙、丙三种化合物, 且甲、乙、丙3分子中含相同数目的质子数,C、D结合生成化合物丁。有关元素的单质和甲、乙、丙、丁四种化合物的转化关系如下图: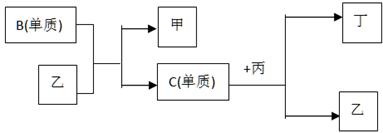
(1)写出B+乙→甲+C的化学反应方程式________________________________________。
(2)根据以上条件可以确定A、B、C、D四种元素中的三种,不能被确定的第四种元素是_____。(填写序号)
① A ② B ③ C ④ D
(3) 依据下列条件可以进一步确定上述第四种元素:
①甲与丙以及乙与丙均能够发生反应,②甲、丙、丁都是无色有刺激性气味的物质。
据此,请回答下列问题:
A.写出上述第四种元素在周期表中的位置 。
B.写出C+丙→乙+丁的化学反应方程式 。
氮化硼(BN)是一种重要的功能陶瓷材料,以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,如下图所示:
请回答下列问题:
1)由B2O3制备BF3、BN的化学方程式依次是 、 ;
2)基态B原子的电子排布式为 ;B和N相比,电负性较大的是 ,BN中B元素的化合价为 ;
3)在BF3分子中,F-B-F的键角是 ,B原子的杂化轨道类型为 ,BF3和过量NaF作用可生成NaBF4,BF4-的立体构型为 ;
4)在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为 ,层间作用力为 ;
5)六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,硬度与金刚石相当,晶胞边长为361.5pm,立方氮化硼晶胞中含有 个氮原子、 个硼原子,立方氮化硼的密度是 g/cm3(只要求列算式,不必计算出数值。阿伏伽德罗常数为NA)。
下表是周期表中的一部分,根据A-I在周期表中的位置,第(1)~ (4)小题用元素符号或化学式回答,(5)~(8)小题按题目要求回答。
| 族 周期 |
I A |
Ⅱ A |
Ⅲ A |
Ⅳ A |
Ⅴ A |
Ⅵ A |
Ⅶ A |
O |
| 1 |
A |
|
|
|
|
|
|
|
| 2 |
|
|
|
D |
E |
|
G |
I |
| 3 |
B |
|
C |
|
F |
|
H |
|
(1)表中元素,化学性质最不活泼的是 ,只有负价而无正价的是 ,氧化性最强的单质是 ,还原性最强的单质是 。
(2)最高价氧化物的水化物碱性最强的是 ,酸性最强的是 ,呈两性的是 。
(3)A分别与D、E、F、G、H形成的化合物中,最稳定的 ,
(4)在B、C、E、F、G、H中,原子半径最大的是 ,
(5)A和D组成化合物的电子式 ,
(6)A和E组成化合物的化学式 ,
(7)用电子式表示B和H组成化合物的形成过程 ,
(8)B的最高价氧化物的水化物和C的最高价氧化物相互反应的离子方程式
。
化合物A最早发现于酸牛奶中,它是内糖代谢的中间体,可由马铃薯、玉米淀粉等发酵制得,A的钙盐是人们喜爱的补钙剂之一。A在某种催化剂的存在下进行氧化,其产物不能发生银镜反应。在浓硫酸存在下,A可发生如下图所示的反应。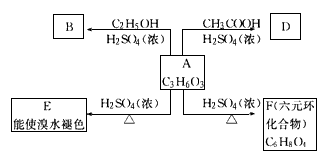
试写出:
(1)化合物A含有的官能团的名称: ___________________________
(2)化合物的结构简式: B _________ D _________
(3)化学方程式:A E __________ A
E __________ A F ____________
F ____________
(4)反应类型:A E __________,A
E __________,A F ___________
F ___________
为了证明铜与稀硝酸反应产生一氧化氮,某校学生实验小组设计了一个实验,其装置如下图所示(加热装置和固定装置均已略去),B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是可控制气体流向,用于鼓入空气的双连打气球。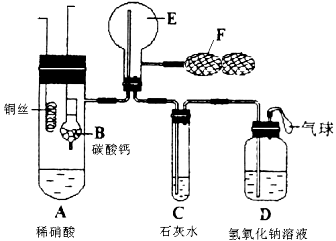
(1) 实验时,先将B装置下移,使碳酸钙与稀硝酸接触产生气体,当C处产生白色沉淀时,立刻将B装置上提,使之与稀硝酸分离。该组学生设计此步操作的目的为
__________________________________。
(2)将A中铜丝放入稀硝酸中,给装置A微微加热,在装置A中产生无色气体,其反应的化学方程式为______________________。
(3)装置E中开始时出现浅红棕色,原因是__________________________;用F向E中鼓入空气后,可观察到烧瓶E内气体颜色加深,产生上述现象的原因是__________________________________。
(4)一段时间后,C中白色沉淀溶解,其原因是_________________________________;
。(用化学方程式表示)
(5)装置D的作用是_____________________________________________________。
某化学研究性学习小组探讨Fe3+和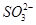 之间发生怎样的反应,请你一起参与并协助他们完成实验。(1)提出猜想:
之间发生怎样的反应,请你一起参与并协助他们完成实验。(1)提出猜想:
甲同学认为发生氧化还原反应,其反应方程式为____________________________________。
乙同学认为发生双水解反应,其反应方程式为2Fe3++3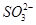 +6H2O===2Fe(OH)3(胶体)+3H2SO3。
+6H2O===2Fe(OH)3(胶体)+3H2SO3。
……
(2)实验验证:
丙同学设计了下列实验来探究反应的可能性。
①为了检验所用Na2SO3是否变质,应选用的试剂是___ _____。
②取5 mL FeCl3溶液于试管中,逐滴加入Na2SO3溶液至过量,观察到溶液颜色由黄色变为红棕色(无气泡产生,也无沉淀生成)。
③将②溶液分成两等份,其中一份加入稀盐酸至过量,再加入BaCl2稀溶液,有白色沉淀生成;另一份滴入几滴KSCN溶液,溶液变成血红色。
(3)得出结论:
①根据丙同学的实验得出的结论是:________________ ____________。
②实验③中溶液变成血红色的有关离子方程式为_________ ____。
(4)拓展探究:
①丁同学在FeCl3溶液中加入Na2CO3溶液,观察到红褐色沉淀并且产生无色气体,该反应的离子方程式是________ __________________。
②从形式上看,Na2CO3和Na2SO3相似,但是从上述实验中可以看到,两者的水溶液与氯化铁溶液反应的现象差别很大,其可能的原因除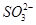 水解能力较
水解能力较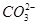 小外,还有_ _______。
小外,还有_ _______。
(1)二甲苯苯环上的一溴代物有六种同分异构体,这些一溴代物与生成它的对应二甲苯的熔点分别为:
| 一溴代二甲苯 |
234℃ |
206℃ |
213.8℃ |
204℃ |
214.5℃ |
205 |
| 对应的二甲苯 |
-13℃ |
-54℃ |
-27℃ |
-54℃ |
-27℃ |
-54℃ |
熔点为234℃分子的结构简式为____________
(2)完全燃烧下列烃①丙烷(C3H8)、②丁烯(C4H8)、③乙烯(C2H4)、④己烷(C6H14),等物质的量的上述四种烃,耗氧量最小的为 (填写序号);等质量时,则耗氧量最大的为 (填写序号)。
(3)0.2 mol某烃A在氧气中完全燃烧后,生成CO2和H2O各1.2 mol。试回答:
① 若烃A不能使溴水褪色,但在一定条件下能与氯气发生取代反应,其一氯取代物只有一种,则烃A的结构简式为__________________。
② 若烃A能使溴水褪色,在催化剂作用下,与H2加成反应后生成2,2-二甲基丁烷,则烃A的名称是________________。
(4)组成符合CnH2n-2的某种烃,分子结构中没有支链或侧链。它完全燃烧时所消耗O2的体积是同状况下该烃蒸气体积的8.5倍,由此分析回答:
①若该烃为链状二烯烃,并且与等物质的量的Br2加成后只能得到单一产物,则该烃的结构简式为______________________________________
②若该烃只能与等物质的量的Br2发生加成反应,则其结构简式为______________(填任一种)。
一水硫酸四氨合铜(Ⅱ)(化学式为[Cu(NH3)4]SO4·H2O)是一种重要的染料及农药中间体。某学习小组以孔雀石(主要成分为Cu2(OH)2CO3,含少量Fe2O3和SiO2杂质)为原料制备该物质的流程如下: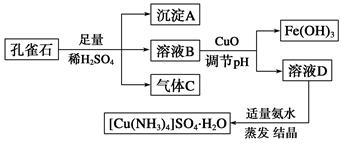
请回答:
(1)沉淀A的晶体中最小环上的原子个数为________,气体C分子中σ键和π键的个数比为________。
(2)溶液D的溶质阴离子的空间构型为__________,其中心原子的杂化轨道类型为________。
(3)MgO的熔点高于CuO的原因为______________________________________。
(4)画出一水硫酸四氨合铜(Ⅱ)中配离子([Cu(NH3)4]2+)的配位键________________。
(5)一种铜金合金晶体具有面心立方最密堆积的结构。在晶胞中,Au原子位于顶点,Cu原子位于面心,则该合金中Au原子与Cu原子个数之比为 ,若该晶胞的边长为a pm,则合金的密度为 g·cm-3(只要求列算式,不必计算出数值,阿伏伽德罗常数为NA)。
化合物A(C11H8O4)在氢氧化钠溶液中加热反应后再酸化可得到化合物B和C。回答下列问题:
⑴B的分子式为C2H4O2,分子中只有一个官能团。则B的结构简式是________,B与乙醇在浓硫酸催化下加热反应生成D,该反应的化学方程式是______________________,该反应的类型是________;写出两种能发生银镜反应的B的同分异构体的结构简式__________________________。
⑵C是芳香化合物,相对分子质量为180,其碳的质量分数为60.0%,氢的质量分数为4.4%,其余为氧,则C的分子式是_____________。
⑶已知C的芳环上有三个取代基,其中一个取代基无支链,且还有能使溴的四氯化碳溶液褪色的官能团及能与碳酸氢钠溶液反应放出气体的官能团,则该取代基上的官能团名称是 。另外两个取代基相同,分别位于该取代基的邻位和对位,则C的结构简式是 。
⑷A的结构简式是 。
W、X、Y、Z是原子序数依次增大的同一短周期元素,W、X是金属元素,Y、Z是非金属元素。
(1)W、X各自的最高价氧化物对应的水化物可以反应生成盐和水,该反应的离子方程式为_____________________。
(2)W与Y可形成化合物W2Y,该化合物的电子式为___________________________。
(3)Y的低价氧化物通入Z单质的水溶液中,发生反应的化学方程式为___________。
(4)比较Y、Z气态氢化物的稳定性:___________>___________。(用分子式表示)
(5)W、X、Y、Z四种元素简单离子的离子半径由大到小的顺序是________(用元素符号表示)。
(6)Z的最高价氧化物为无色液体,0.25 mol该物质与一定量水混合得到一种稀溶液,并放出Q kJ的热量。写出该反应的热化学方程式:_____________________________。
已知:R—CH===CH—O—R′ R—CH2CHO+
R—CH2CHO+
(烃基烯基醚)
R′OH,烃基烯基醚A的相对分子质量(Mr)为176,分子中碳氢原子数目比为3∶4,与A相关的反应如下:
请回答下列问题:
(1)A的分子式为________.
(2)B的名称是________;A的结构简式为________.
(3)写出C―→D反应的化学方程式:______________________________________
________________________________________________________________________.
(4)写出两种同时符合下列条件的E的同分异构体的结构简式:________、________.
①属于芳香烃;
②苯环上有两种不同环境的氢原子.
有机物A为茉莉香型香料
(1)A分子中含氧官能团的名称是____________.
(2)C的分子结构可表示为(其中R和R′代表不同的烃基):
A的化学式是__________,A可以发生的反应是________________(填字母序号).
a.还原反应 b.加成反应 c.氧化反应 d.水解反应
(3)已知含有烃基R的有机物R—OH与浓溴水反应产生白色沉淀,则含有烃基R′的有机物R′—OH的类别属于____________________.
(4)A分子结构中只有一个甲基,A的结构简式是_____________________________
________________________________________________________________________.
关于银镜反应的实验操作步骤如下:
| A.在试管中先注入少量NaOH溶液,振荡,加热煮沸之后把NaOH溶液倒去,再用蒸馏水洗净试管备用. |
| B.在洗净的试管里配制银氨溶液. |
| C.向银氨溶液中滴入3~4滴乙醛稀溶液. |
| D.加热. |
请回答下列问题:
(1)步骤A中加NaOH溶液振荡,加热煮沸的目的是_____________________________
________________________________________________________________________.
(2)简述银氨溶液的配制过程:__________________________________________
________________________________________________________________________.
(3)写出乙醛发生银镜反应的化学方程式:_____________________________________
________________________________________________________________________.
(4)银氨溶液久置可能会爆炸,直接排放会污染环境,且造成资源浪费,实验室从废液中回收银的实验流程如
已知:[Ag(NH3)2]+ Ag++2NH3
Ag++2NH3
①写出废液与稀硝酸反应的离子方程式:__________________________________
________________________________________________________________________.
②加入铁粉要过量的目的是___________________________________________.
③该实验过程中可能产生的大气污染物是________________________________.
松油醇是一种调味香精,它是α、β、γ三种同分异构体组成的混合物,可由松节油分馏产品A(结构式和H2O中的“18”是为区分2个羟基而人为加上去的)经如图所示反应制得.
试回答:
(1)α松油醇的分子式是________.
(2)α松油醇所属的物质类别是________.
a.醇 b.酚 c.饱和一元醇
(3)α松油醇所能发生的反应类型是________.
a.加成 b.水解 c.氧化
(4)写出结构简式:β松油醇:___________________________________________;
γ松油醇:________________________.
t℃时,将3 mol A和1 mol B气体通人体积为2L的密闭容器中(容积不变),发生如下反应:3 A(g)+B(g)  xC(g),2min时反应达到平衡状态(温度不变),剩余了O.8 mol B,并测得C的浓度为O.4 mol/L,请填写下列空白:
xC(g),2min时反应达到平衡状态(温度不变),剩余了O.8 mol B,并测得C的浓度为O.4 mol/L,请填写下列空白:
(1)从开始反应至达到平衡状态,生成C的平均反应速率为 ;
(2)x=_______;
(3)若继续向原平衡混合物的容器中通入少量氦气(假设氦气和A、B、C都不反应)后,化学平衡(填字母) ( )
A.向正反应方向移动 B.向逆反应方向移动 C.不移动
(4)若向原平衡混合物的容器中再充人a mol C,在t℃时达到新的平衡,此时B的物质的量为n(B)= mol;
(5)如果上述反应在相同温度和容器中进行,欲使反应达到平衡时C的物质的量分数与原平衡相等,起始加入的三种物质的物质的量n(A)、n(B)、n(C)之间应该满足的关系式为 。