已知某物质A有如下转化关系: 
根据上图关系及实验现象,回答下列问题:
(1)A是 ,B是 ,G是 ,X是 (均填化学式)。
(2)写出反应Ⅱ的化学方程式 。
(3)写出反应Ⅲ的离子方程式 。
铝是最常见的金属之一。
(1)浓硝酸、浓硫酸可贮存在铝制容器的原因是 。
(2)纳米铝主要应用于火箭推进剂。工业上利用无水氯化铝与氢化铝锂(LiAlH4)在有机溶剂中反应制得纳米铝,化学方程式如下:3LiAlH4+AlCl3="4Al" + 3LiCl + 6H2↑
该反应的氧化剂为 。
(3)氢化铝钠(NaAlH4)是一种重要的储氢材料,已知:
NaAlH4(s)=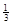 Na3AlH6 (s)+
Na3AlH6 (s)+ 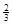 Al (s) + H2(g) ΔH=+ 37 kJ·molˉ1
Al (s) + H2(g) ΔH=+ 37 kJ·molˉ1
Na3AlH6(s)="3NaH(s)+" Al (s) + 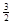 H2(g) ΔH=+ 70.5 kJ·molˉ1
H2(g) ΔH=+ 70.5 kJ·molˉ1
则NaAlH4(s)=" NaH(s)" + Al (s) +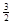 H2(g) ΔH= 。
H2(g) ΔH= 。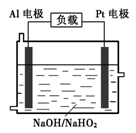
(4)已知H2O2是一种弱酸,在强碱性溶液中主要以HO2-形式 存在。目前研究比较热门的Al-H2O2燃料电池,其原理如右图所示,电池总反应如下:
2Al+3HO2-+3H2O =2[Al(OH) 4]-+OH-
①正极反应式为 。
②与普通锌锰干电池相比,当消耗相同质量的负极活性物质时,Al-H2O2燃料电池的理论放电量约为普通锌锰干电池的______倍。
③Al电极易被NaOH溶液化学腐蚀,这是该电池目前未能推广使用的原因之一。反应的离子方程式为 。
有机化合物A~E的转化如下列反应框图所示, 1 mol A和2 mol H2在一定条件下恰好反应,生成饱和一元醇X,X中碳元素的质量分数约为65%。 (1)X的分子式为 。
(1)X的分子式为 。
(2) A分子中所含官能团的名称是 。
(3)上述转化①~④步反应中,属于取代反应类型的是 (填序号)。
(4)C的结构简式为 。
(5) D→E的反应方程式为 。
Ⅰ.在一定体积的密闭容器中,进行如下化学反应:其化学平衡常数K与温度t的关系如下:CO2(g)+H2(g)  CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
| t(℃) |
700 |
800 |
830 |
1000 |
1200 |
| K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
请回答下列问题:
(1)该反应为 反应(填“吸热”或“放热”)。
(2)800℃,固定容器的密闭容器中,放入混合物,其始浓度为c(CO) =" 0.01" mol/L,c(H2O) =" 0.03" mol/L,c(CO2) =" 0.01" mol/L,c(H2) =" 0.05" mol/L,则反应开始时,H2O的消耗速率比生成速率 __ _(填“大”、“小”或“不能确定”)。
Ⅱ.超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究催化技术将尾气中的NO和CO转变成CO2和N2,其反应为:2NO+2CO 2CO2+N2。为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
2CO2+N2。为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
| 时间(s) |
0 |
1 |
2 |
3 |
4 |
5 |
| c(NO) (mol/L) |
1.00×10-3 |
4.50×10-4 |
2.50×10-4 |
1.50×10-4 |
1.00×10-4 |
1.00×10-4 |
| c(CO) (mol/L) |
3.60×10-3 |
3.05×10-3 |
2.85×10-3 |
2.75×10-3 |
2.70×10-3 |
2.70×10-3 |
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
(1)在上述条件下反应能够自发进行,则反应的△H 0(填写“>”、“<”、“=”)。
(2)前2s内的平均反应速率v(N2)= 。
(3)在该温度下,反应的平衡常数K= 。
(4)假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是 。
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积
(5)若在恒温、恒压条件下向平衡体系中通入氩气,则平衡 移动(填“向左”“向右”或“不”);使用催化剂,上述反应的△H________(填“增大” “减小” 或“不改变”)。
(1)某温度下,纯水中c [H+]=2.0×10-7 mol/L,则此时c [OH-] = mol/L,水的离子积Kw= ;相同条件下,测得① Na2CO3(aq)② CH3COONa(aq)③ NaClO(aq)三种稀溶液的pH值相同。那么,它们的物质的量浓度由大到小的顺序是 。
(2)pH值相同的 HCl(aq)、H2SO4(aq)、 CH3COOH(aq)各100 mL
①三种溶液中物质的量浓度最大的是 ;
②分别用0.1 mol/L的NaOH(aq)中和,消耗NaOH(aq)的体积分别为V1、V2、V3,它们由大到小的顺序是 。
③反应开始时,反应速率 。(从下面选项中选择填写)
| A.HCl最快; | B.H2SO4最快; | C.CH3COOH最快; | D.一样快 |
(3)0.020 mol/L的HCN(aq)与0.020 mol/L NaCN(aq)等体积混合,已知该混合溶液中c (Na+) > c( CN-),用“>、<、=”符号填空
①溶液中c (OH-) c (H+) ②c (HCN) c (CN-)
(4)①Na2CO3溶液的pH 7(填“>、<、=”),
其原因是 (用离子方程式表示)
②若溶液Na2CO3溶液和Al2(SO4)3溶液混合,观察到有白色絮状沉淀和无色气体生成,该反应的离子方程式为
(5)下表是不同温度下水的离子积常数:
| 温度/℃ |
25 |
t1 |
t2 |
| 水的离子积常数(mol2·L-2) |
1×10-14 |
a |
1×10-12 |
试回答以下问题:
①若25<t1<t2,则a__________1×10-14 mol2·L-2(填“>”、“<”或“=”),做此判断的理由是________________________。
②25℃时,某Na2SO4溶液中c(SO42-)=5×10-4 mol/L,取该溶液1 mL加水稀释至10 mL,则稀释后溶液中c(Na+)∶c(OH-)=__________。
③t2℃时,将pH=11的苛性钠溶液V1 L与pH=1的稀硫酸V2 L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1∶V2=________。此溶液中各种离子的浓度由大到小的顺序是_______ _____。
芳香族化合物A只有两个对位取代基,在一定条件下有如下图所示转化关系。其中,1 mol C与Na完全反应生成1 mol H2,若l mol C与NaHCO3完全反应,也产生l mol气体,E可以使溴的四氯化碳溶液褪色。
(1)D分子中的含氧官能团名称是___________,A的结构简式是___________。
(2)反应④的基本类型是_______反应,反应⑤的化学方程式是___________________________ 。
(3)与C取代基位置相同,既能与FeCl3溶液显色、又能发生水解反应的结构简式为: ,___________、___________。(写两种即可)
,___________、___________。(写两种即可)
(4)现有C和E的混合物n mol。在空气中完全燃烧消耗O2___________L(标准状况),若生成CO2 a L(标准状况)、H2O b g,则C、E混合物中含E的物质的量的计算式为:______________________ 。
植物精油具有抗菌消炎、解热镇痛等药物功用。从樟科植物枝叶中提取的精油中含有下列甲、乙、丙三种成分: 丙:分子式C16H14O2
丙:分子式C16H14O2
(1)甲、乙中含氧官能团的名称分别为___________ 、___________。
(2)经下列过程甲可转化为乙:
①,②的反应类型分别为___________、___________ 。
(3)通过下列合成路线由乙可得到丙(部分反应产物略去)

①F的结构简式为_________________________________________________________________。
②由乙制取D的化学方程式_______________________________________________________。
③写出同时符合下列要求的D的同分异构体的结构简式______________________。
a.化合物是二取代苯
b,分子中有5种不同环境的氢原子,其个数比为1:2:2:1: 2
c.能使溴的CCl4溶液褪色,且在酸性条件下可以发生水解反应
④丙的结构简式为_________________。
已知:

有机物E和F可用作塑料增塑剂或涂料的溶剂,它们的相对分子质量相等,可以用下列方法合成。
(1)写出有机物的名称: ,
, 。
。
(2)写出下列反应的化学方程式。
①A+C→E 。
②CH2=CH2 D 。
D 。
(3)E和F的相互关系是 。
| A.同一种物质 | B.同素异形体 | C.同系物 | D.同分异构体 |
某研究性学习小组做了以下实验:向溴水中加入足量乙醛溶液,观察到溴水褪色的现象。
[提出问题]
产生上述现象的原因是什么?
[提出猜想]
①溴水与乙醛发生取代反应。
②___________________________________________________。
③___________________________________________________。
[设计方案]
方案一:检验褪色后溶液的酸碱性。
方案二:测定反应前溴水中Br2的物质的量和反应后Br-离子的物质的量。
[实验探究]
取含0.005mol Br2的溶液10mL,加入足量乙醛溶液使其褪色,再加入过量AgNO3溶液,过滤、洗涤、干燥后称重固体质量为1.88g。
[解释与结论]
假设测得反应前溴水中Br2的物质的量为a mol,
若测得反应后n(Br-)=0mol,则说明溴水与乙醛发生了____________反应。
若测得反应后n(Br-)=amol,则说明溴水与乙醛发生了____________反应。
若测得反应后n(Br-)=2amol,则说明溴水与乙醛发生了____________反应。
若已知CH3COOAg易溶解于水,试通过计算判断溴水与乙醛发生反应的类型为___________。
理由是_________________________________________ _________________。
其反应方程式为_______________________________________________________。
[反思与评价]
方案一是否可行?__________。理由是_______________________________________。
下图表示取1 mol乙烯雌酚进行的四个实验,下列对实验数据的预测与实际情况吻合的是( )
| A.①中生成7 mol H2O | B.②中生成2 mol CO2 |
| C.③中最多消耗3 mo1 Br2 | D.④中最多消耗7 mol H2 |
有机物A是最常用的食用油抗氧化剂,分子式为C10H12O5,可发生如下转化:




 已知B的相对分子质量为60,分子中只含一个甲基。C的结构可表示为:
已知B的相对分子质量为60,分子中只含一个甲基。C的结构可表示为:
请回答下列问题:
(1)B的结构简式为 C中含有的官能团-X的名称为
(2)反应④的反应类型为
(3)反应①的化学方程式为
(4)从分子结构上看,A作为食用油抗氧化剂的主要原因是
a.含有苯环 b.含有羰基 c.含有酚羟基
(1)土壤的pH一般在4~9之间。土壤中Na2CO3含量较高时,pH可以高达10.5,试用离子方程式解释土壤呈碱性的原因 ;加入石膏(CaSO4 2H2O)可以使土壤碱性降低,有关反应的化学方程式为 。
2H2O)可以使土壤碱性降低,有关反应的化学方程式为 。
(2)在一定条件下进行如下反应:aX(g)+bY(g) cZ(g)
cZ(g)
右图是不同温度下反应达到平衡时,反应混合物中Z的体积分数 和压强关系示意图。
① 写出该反应的化学平衡常数表达式:K= 。随着温 度的升高,K值 (填“增大”、“减小”或“不变”)。当反应物起始浓度相同时,平衡常数K值越大,表明 (字母填序号)。
| A.X的转化率越高 | B.反应进行得越完全 |
| C.达到平衡时X的浓度越大 | D.化学反应速率越快 |
② 如右图所示,相同温度下,在甲、乙两容器中各投入1molX、2molY和适量催化剂,甲乙两容器的初始体积均为1L,甲、乙容器达到平衡所用时间:甲 乙(填“>”、“<”或“=”,下同),平衡时X和Y的转化率:甲 乙。
常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表,请回答:
| 实验编号 |
HA物质的量浓度 (mol·L-1) |
NaOH物质的量浓度 (mol·L-1) |
混合溶液的pH |
| 甲 |
0.2 |
0.2 |
pH=a |
| 乙 |
c |
0.2 |
pH=7 |
| 丙 |
0.2 |
0.1 |
pH>7 |
| 丁 |
0.1 |
0.1 |
pH=9 |
(1)不考虑其它组的实验结果,单从甲组情况分析,如何用a (混合溶液的pH)来说明HA是强酸还是弱酸________________。
(2)不考虑其它组的实验结果,单从乙组情况分析,C是否一定等于0.2 ____(选填“是”或“否”)。混合液中离子浓度c(A-)与 c(Na+)的大小关系是_________________。
(3)丙组实验结果分析,HA是 酸(选填“强”或“弱”)。该混合溶液中离子浓度由大到小的顺序是 。
(4)丁组实验所得混合溶液中由水电离出的c(OH-)= mol·L-1。写出该混合溶液中下列算式的精确结果(不需做近似计算)。
c(Na+)-c(A-)= mol·L-1 c(OH-)-c(HA)= mol·L-1。
我国是个钢铁大国,钢铁产量为世界第一,高炉炼铁是最为普遍的炼铁方法。高炉内可能发生的反应:
C(s)+O2(g)=CO2(g) ΔH1=-393.5kJ/mol ①
C(s)+ CO2(g)  2CO(g) ΔH2="+172.5" kJ/mol ②
2CO(g) ΔH2="+172.5" kJ/mol ②
4CO(g)+Fe3O4(s)=4CO2(g)+3Fe(s) ΔH3="-13.7" kJ/mol ③
请回答下列问题:
(1) 计算3 Fe(s)+2 O2(g)= Fe3O4(s)的ΔH=__________________________。
(2) 800℃时,C(s)+ CO2(g)  2CO(g)的平衡常数K=1.64,相同条件下测得高炉内c(CO)=0.2mol/L、c(CO2)=0.05mol/L,此时反应向_______(填“正”或“逆”)方向进行。
2CO(g)的平衡常数K=1.64,相同条件下测得高炉内c(CO)=0.2mol/L、c(CO2)=0.05mol/L,此时反应向_______(填“正”或“逆”)方向进行。
(3) 某种矿石中铁元素以氧化物FemOn形式存在,现进行如下实验:将少量铁矿石样品粉碎,称取25.0g样品于烧杯中,加入稀硫酸充分溶解,并不断加热、搅拌,滤去不溶物。向所得滤液中加入10.0g铜粉充分反应后过滤、洗涤、干燥得剩余固体3.6 g。剩下滤液用浓度为2 mol/L的酸性KMnO4滴定,至终点时消耗KMnO4溶液体积25.0 mL。
提示:2Fe3++Cu=2Fe2++Cu2+ 8H++MnO4-+5Fe2+=Mn2++5Fe3++4H2O
计算:①该铁矿石中铁元素的质量分数。
②计算氧化物FemOn的化学式( m、n为正整数)。