某小组欲探究Cl2与KI溶液的反应,设计实验装置如下图。

已知:I2在水中溶解度很小,在KI溶液中溶解度显著增大,I2(S) + I- I3-(aq)。
I3-(aq)。
容器中盛放的试剂分别为:
A.MnO2
C.0.5000 mol/L的KI溶液
D.AgNO3溶液
E.NaOH溶液
F.浓盐酸
完成下列填空:
(1)仪器A的名称 ,B中的试剂是_________________。
(2)当D装置中出现 时,停止加热;E的作用是_______________。
(3)当氯气开始进入C时,C中看到的现象是____________________;不断向C中通入氯气,看到溶液颜色逐渐加深,后来出现深褐色沉淀,试运用平衡移动原理分析产生这些现象的原因___________________。
(4)持续不断地向C中通入氯气,看到C中液体逐渐澄清,最终呈无色。推测此时C中无色溶液里含碘物质的化学式_________________(此时溶液中只有一种含碘微粒)。
为确定含碘物质中碘元素的化合价,进行如下实验:
① 取反应后C中溶液5.00mL(均匀)于锥形瓶中,加入KI(过量)和足量稀硫酸。
②向上述锥形瓶中滴加淀粉指示剂,溶液变蓝,用0.6250 mol/L的Na2S2O3溶液滴定至蓝色刚好褪去,耗Na2S2O3溶液24.00 mL。
已知: I2 + 2 S2O32-→ 2 I-+ S4O62-
计算:碘元素的化合价为_______________。
(5)欲检验某溶液中是否含有I-,可使用的试剂为氯水和淀粉溶液。合理的实验操作为_________________________________。
Na2S又称臭碱、硫化碱,是应用广泛的化工原料,也常用于吸收工业废气中的SO2。
完成下列填空:
(1)用离子方程式说明Na2S又称臭碱、硫化碱的原因___________________________。
(2)向AgCl悬浊液中滴加Na2S溶液,生成黑色沉淀,写出反应的离子方程式________。结合你所学习过的其它离子反应分析,离子互换反应进行的方向是_________________。向Na2S溶液中不断通入SO2,直至不再能吸收。其间看到溶液变浑浊,停止反应后溶液中含硫微粒为:S2O32-、HSO3-、H2SO3、HS-。
(3)反应过程中,溶液的pH逐渐_____________(填“变大”、“变小”),生成的沉淀是_____________;
(4)关于反应后得到的溶液,下列离子浓度关系正确的是___________。
a.c(Na+) = c(S2O32-) + 2 c(HSO3-) + 2c(H2SO3) + 2 c(HS-)
b.c(Na+) + c(H+) =" 2" c(S2O32-) + c(HSO3-) + c(HS-) + c(OH-)
c.c(Na+) =" 2" c(HS-)
二氧化氯(ClO2)是国际公认高效、安全的杀菌、保鲜剂,是氯制剂的理想替代品。工业上制备ClO2的方法很多,NaClO3和NaClO2是制取ClO2的常见原料。
完成下列填空:
(1)以下反应是制备ClO2的一种方法:H2C2O4 + 2 NaClO3 + H2SO4 → Na2SO4 + 2 CO2↑ + 2 ClO2↑ + 2 H2O,上述反应物中属于第三周期的元素的原子半径大小顺序是__________;其中原子半径最大元素的原子,其核外有 种不同能量的电子。
(2)ClO2的分子构型为“V”形,则ClO2是______________(选填“极性”、“非极性”)分子,其在水中的溶解度比氯气__________(选填“大”、“小”、“一样”)。
(3)ClO2具有强氧化性,若ClO2和Cl2在消毒时自身均被还原为Cl-,ClO2的消毒能力是等质量Cl2的___________倍(保留2位小数)。
(4)若以NaClO2为原料制取ClO2,需要加入具有________(填“氧化”、“还原”)性的物质。
(5)工业上将氯碱工业和制取NaClO3联合进行。研究发现,电解时,不同反应环境下的总反应分别为:
4 NaCl + 18 H2O → 4 NaClO3 + 3 O2↑+ 18 H2↑(中性环境)
NaCl + 3 H2O → NaClO3 + 3 H2↑(微酸性环境)
①电解时,氢气在__________极产生。
②更有利于工业生产NaClO3的反应环境是___________,理由__________________。
今有一混合物的水溶液,可能含有以下离子中的若干种:K+、NH4+、Mg2+、Ba2+、Cl-、CO32-、SO42-,现取两份100 mL溶液分别进行如下实验:(1)加入AgNO3溶液有沉淀产生;(2)加足量BaCl2溶液,得干燥沉淀6.27 g,经足量盐酸洗涤、干燥后,沉淀质量为2.33 g。根据上述实验,以下推测正确的是
| A.NH4+可能存在 |
| B.若焰色反应测得K+存在,则NH4+不一定存在 |
| C.Cl-不可能存在 |
| D.Ba2+一定不存在,Mg2+可能存在 |
NA代表阿伏伽德罗常数的值。K35ClO3与H37Cl反应后生成氯气、氯化钾和水。下列说法正确的是
| A.生成氯气的相对分子质量为71 | B.生成1 mol氯化钾转移5 NA个电子 |
| C.生成氯化钾的摩尔质量为76 g/mol | D.1molH37Cl参加反应转移NA个电子 |
常温下已知两种一元弱酸HX和HY,如果向NaX溶液中通CO2气体,只能生成HX和NaHCO3;往NaY溶液中通入CO2则生成HY和Na2CO3。有关叙述正确的是
| A.三种酸的电离常数:Ki1(H2CO3) > Ki(HX) > Ki(HY) > Ki2(H2CO3) |
| B.NaX溶液中通入足量CO2后的离子浓度:c(HCO3-)>c(CO32-)>c(X-) |
| C.同浓度溶液的碱性:NaX > Na2CO3 > NaY > NaHCO3 |
| D.结合H+的能力:Y- > CO32- > X- > HCO3- |
欲证明SO2与Ba2+只有在碱性条件下才能形成BaSO3沉淀,有下列溶液可供选择:①Ba(OH)2溶液 ②Ba(NO3)2溶液 ③BaCl2溶液 ④HCl。必须用到的试剂是
| A.① | B.①② | C.①③ | D.①③④ |
某溶液中可能含有Fe2+、Mg2+、Cu2+、NH4+、Al3+。当加入一种淡黄色固体并加热溶液时,有刺激性气味的气体放出和白色沉淀生成,加入淡黄色固体物质的量(横坐标)与析出的沉淀和产生气体的物质的量(纵坐标)的关系,如图所示。

(1)写出反应②和④的离子方程式
② 。
④ 。
(2)溶液中含有的离子是 ,它们的物质的量浓度之比为 。
某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质,甲同学设计了如图所示的实验装置(支撑用的铁架台省略),按要求回答问题。
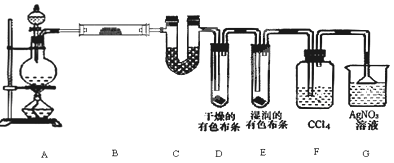
(1)写出装置A发生反应的离子方程式 。
若用含有0.2mol HCl的浓盐酸与足量的MnO2反应制Cl2,制得的Cl2体积(标准状况下)总是小于1.12L的原因是
(2)①装置B中盛放的试剂名称为 ,现象是 。
②装置D和E中出现的不同现象说明的问题是 。
③装置F的作用是 。
(3)乙同学认为甲同学的实验有缺陷,不能确保最终通入AgNO3溶液中的气体只有一种。为了确保实验结论的可靠性,证明最终通入AgNO3溶液的气体只有一种,乙同学提出在某两个装置之间再加一个装置。你认为该装置应加在 与 之间(填装置字母序号),装置中应放入 (填写试剂或用品名称)。
M是一种单质,A、B、C、D、E、F、G都是含有同一种元素的物质,这七种物质相互转变的关系如下图所示:

(1)写出下列物质的颜色:
M F ,
(2)写出下列变化的化学方程式
A→B: 该反应中每消耗0.3 mol的A,可转移电子 mol。
E→G ;
D→C 。
(3)上述反应中,属于氧化还原反应的有 个
由Na2O2、Na2CO3、NaHCO3、NaCl中某几种组成的混合物,向其中加入足量的盐酸有气体放出.将气体通过足量的NaOH溶液,气体体积减少一部分。将上述混合物在密闭容器中加热,有气体放出,下列判断正确的是
| A.混合物中一定不含有Na2CO3、NaCl | B.混合物中一定有Na2O2、NaHCO3 |
| C.无法确定混合物中是否含有NaHCO3 | D.混合物中一定不含Na2O2、NaCl |
实验室将NaClO3和Na2SO3按物质的量之比2∶1倒入烧瓶中,用水浴加热,同时滴入H2SO4,产生棕黄色气体X,反应后测得NaClO3和Na2SO3恰好完全反应,则X为
| A.Cl2 | B.Cl2O | C.Cl2O3 | D.ClO2 |
一定量CO2通入某浓度的NaOH溶液得溶液A,向A溶液中逐滴滴入稀盐酸,加入n(HCl)与生成n(CO2)的关系如图所示,下列有关叙述正确的是
| A.通入的CO2气体在标准状况下可能大于22.4 L |
| B.A溶液中n(NaOH)=2n(Na2CO3) |
| C.A溶液中既含Na2CO3,又含NaHCO3 |
| D.A溶液中一定只有Na2CO3 |
事实上,许多非金属氧化物在一定条件下能与Na2O2反应,且反应极有规律,如:
Na2O2 +SO2 = Na2SO4 2Na2O2 +2SO3= 2Na2SO4 +O2↑,你认为下列方程式中不正确的是
| A.2Na2O2 + 2Mn2O7 = 4NaMnO4 + O2↑ | B.2Na2O2 + P2O3= Na4P2O7↑ |
| C.2Na2O2 + 2N2O3= 4NaNO2 + O2↑ | D.2Na2O2 + 2N2O5= 4NaNO3+ O2↑ |