某学校化学科研小组从文献资料上获得如下信息:NaHCO3在潮湿的空气中会缓慢分解成Na2CO3、H2O和CO2。为了验证这一信息,该科研小组将一瓶在潮湿空气中久置的NaHCO3样品混合均匀后,进行如下实验:
(1)在一个质量为a g的蒸发皿中加入一些样品,称得总质量为b g。用酒精灯对其充分加热,冷却后称得其总质量为c g。残留在蒸发皿中的固体是(填化学式)___ ___。
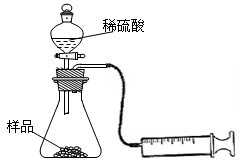
(2)另称取相同质量的样品放入锥形瓶中,实验装置如右图所示。为了保证实验成功,所选用针筒的最大刻度值应大于或等于__ __(mL)。(设实验在标准状况下进行)
(3)打开活塞逐滴加入稀硫酸,至没有气泡产生为止。针筒中收集到气体折算成标准状况下的体积为V mL(滴入稀硫酸的体积及针筒活塞的内壁的摩擦力忽略不计)。该科研小组设称取的每份样品中的Na2CO3、NaHCO3的物质的量分别为x、y,且没有利用化学方程式进行计算,就列出了如下算式:x + y =" V" mL/22400 mL·mol—1,他们依据的原理是___ ___。根据相似原理,请完成下列算式:2x + y =___ ___由上述两算式,该科研小组通过计算,得出了样品中的Na2CO3、NaHCO3的质量分数。
下图是一些常见的单质.化合物之间的转化关系图,有些反应中的部分物质被略去。常温常压下,A为无色有毒气体,B为红棕色粉末,C、E为金属单质。反应①②均为工业上的重要反应。

请回答下列问题:
(1)D的电子式为__ ___。
(2)K的化学式为___ ___。
(3)写出B与C高温反应生成E和F的化学方程式:___ __。
(4)写出D与J的稀溶液反应生成G的离子方程式:__ ___。
某溶液中可能含有下列6种离子中的某几种:Cl—、SO42—、CO32—、NH4+、Na+、K+。为确认溶液组成进行如下实验:(1)200mL上述溶液,加入足量BaCl2溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀4.30g,向沉淀中加入过量的盐酸,有2.33g沉淀不溶。(2)向(1)的滤液中加入足量的NaOH溶液,加热,产生能促使湿润红色石蕊试纸变蓝的气体1.12L(已换算成标准状况,假定产生的气体全部逸出)。由此可以得出关于原溶液组成的正确结论是
| A.一定存在SO42—、CO32—、NH4+,可能存在Cl—、Na+、K+ |
| B.一定存在Cl—、SO42—、CO32—、NH4+,一定不存在Na+、K+ |
| C.c(CO32—)=0.01mol·L-1,NH4+>SO42— |
| D.如果上述6种离子都存在,则c(Cl—)>c(SO42—) |
高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂。下列反应可制取K2FeO4:
2 Fe(OH)3 +3 Cl2+10KOH 0~30℃ 2 K2FeO4+6KCl+8H2O,对于该反应,下列说法正确的是
| A.水是还原产物 | B.Fe(OH)3发生还原反应 |
| C.Cl2是氧化剂 | D.每生成1mol K2FeO4转移2mol电子 |
铁及其化合物在有机化学中应用广泛,例如有机合成中,常用铁和盐酸将硝基(-NO2)还原为氨基(-NH2);在苯的溴代反应中用溴化铁作催化剂。
(1)Fe基态原子核外电子排布式为 。
(2)H、N、O的电负性从小到大的顺序是 。
(3)与NO2+互为等电子体的一种分子为 (填化学式)。氨基(-NH2)中氮原子的杂化类型为 。
(4)1mol苯分子中含有σ键的数目为 。
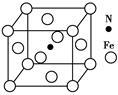
(5)Fe与N形成的某化合物晶胞如图所示,则该晶体的化学式为 。
查尔酮类化合物G是黄酮类药物的主要合成中间体,其中一种合成路线如下:

已知以下信息:
①芳香烃A的相对分子质量在100-110之间,1 mol A充分燃烧可生成72g水。
②C不能发生银镜反应。
③D能发生银镜反应、可溶于饱和Na2CO3溶液、核磁共振氢谱显示其有4中氢。

回答下列问题:
(1)A的化学名称为 。
(2)由B生成C的化学方程式为 。
(3)E的分子式为 ,由生成F的反应类型为 。
(4)G的结构简式为 。
(5)D的芳香同分异构体H既能发生银镜反应,又能发生水解反应,H在酸催化下发生水解反应的化学方程式为 。
(6)F的同分异构体中,既能发生银镜反应,又能与FeCl3溶液发生显色反应的有 种,其中2核磁共振氢谱为5组峰,且峰面积比为2:2:2:1:1的为 (写结构简式)。
化合物A最早发现于酸牛奶中,它是人体内糖代谢的中间体,可由马铃薯玉米淀粉等发酵制得,A的钙盐是人们喜爱的补钙剂之一。A在某种催化剂的存在下进行氧化,其产物不能发生银镜反应。在浓硫酸存在下,A可发生如下图所示的反应。试写出:

(1)化合物的结构简式:A ;B ;D
(2)化学方程式: A→E ;A→F
反应类型: A→E ;A→F
实验室制备1,2-二溴乙烷的反应原理如下:

可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚。 用少量的溴和足量的乙醇制备1,2—二溴乙烷的装置如下图所示:

有关数据列表如下:

回答下列问题:
(1)在此制各实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是 ;(填正确选项前的字母)
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(2)在装置C中应加入 ,其目的是吸收反应中可能生成的酸性气体:(填正确选项前的字母)
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3)判断该制备反应已经结束的最简单方法是 ;
(4)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在 层(填“上”、“下”);
(5)若产物中有少量未反应的Br2,最好用 洗涤除去;(填正确选项前的字母)
a.水 b.氢氧化钠溶液 c.碘化钠溶液 d.乙醇
(6)若产物中有少量副产物乙醚.可用 的方法除去;
(7)反应过程中应用冷水冷却装置D,其主要目的是 ;但又不能过度冷却(如用冰水),其原因是 。
X、Y、Z、W是元素周期表前四周期中常见的元素,其相关信息如下表:
| 元素 |
相关信息 |
| X |
X的基态原子L层电子数是K层电子数的2倍 |
| Y |
Y的基态原子最外层电子排布式为:nsnnpn+2 |
| Z |
Z存在质量数为23,中子数为12的核素 |
| W |
W有多种化合价,其白色氢氧化合物在空气中会迅速变成灰绿色,最后变成红褐色 |
(1)W位于元素周期表第 周期第 族,其基态原子最外层有 个电子。
(2)X的电负性比Y的 (填“大”或“小”);X 和Y的气态氢化物中,较稳定的是 (写化学式)。
(3)写出Z2Y2与XY2反应的化学方程式,并标出电子转移的方向和数目:
(4)在X的原子和氢原子形成的多分子中,有些分子的核磁共振氢谱显示两种氢,写出其中一种分子的名称: 。氢元素,X、Y的原子也可共同形成多种分子和几种常见无机阴离子,写出其中一种分子与该无机阴离子反应的离子方程式: 。
Cl2、SO2均能使品红溶液褪色,后者因为品红分子结构中的生色团遇到亚硫酸后结构发生改变,生成不稳定的无色化合物。其漂白原理可用下面的反应方程式表示:
下列说法正确的是
| A.向品红溶液中同时通入Cl2、SO2,漂白效果会更好 |
| B.加热可判断品红褪色是通入SO2还是通入Cl2引起的 |
| C.“无色化合物”分子中,19个碳原子都可能处在同一平面上 |
| D.品红分子结构中,19个碳原子不可能处在同一平面上 |
尼群地平片可用于治疗高血压。它的主要成分的结构简式如右图所示。下列关于这种化合物的说法正确的是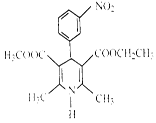
| A.该物质的分子式为C18H20N2O6 |
| B.该物质可以和银氨溶液发生银镜反应 |
| C.该物质属于芳香族化合物,能溶于水 |
| D.该物质在酸性条件下不发生水解反应 |
某羧酸的衍生物A,其分子式为C6H12O2,实验表明A和NaOH溶液共热生成B和C,B和盐酸反应生成有机物D,C在铜作催化剂和加热条件下氧化为E,其中D、E都不能发生银镜反应,由此判断A的可能结构简式有
A.2种 B.3种 C.4 种 D.6种
某化学兴趣小组为探究铜与浓硫酸的反应,用下图所示装置进行有关实验。 甲同学取ag Cu 片和12ml 18mol/L浓H2SO4放入圆底烧瓶中加热,直到反应完毕,最后发现烧瓶中还有一定量的H2SO4和Cu剩余。

(1)Cu与浓H2SO4反应的化学方程式是_____ 。
(2)装置D盛有品红溶液,当C中气体集满后,D中有可能观察到的现象是____________。
(3)装置D中试管口放置的棉花中应浸一种液体,这种液体是__________,其作用是__________ 。
(4)装置B的作用是贮存多余的气体。当D处有明显现象后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有气体产生,此时B中试剂瓶中液面下降,长颈漏斗中液面上升。B中应放置的液体是_______(填序号)。
a.饱和Na2SO3溶液 b.酸性 KMnO4溶液 c.浓溴水 d.饱和NaHSO3溶液
(5)反应完毕后,烧瓶中还有一定量的余酸,为什么却不能使Cu完全溶解的原因是______________ 。使用足量的下列药品不能用来证明反应结束后的烧瓶中的确有余酸的是_________ (填序号)。
a.Fe粉 b.BaCl2溶液 c.CuO d.Na2CO3溶液
(6)实验中某学生向A中反应后溶液中通入一种常见气体单质,使铜片全部溶解且仅生成硫酸铜溶液,请问该气体单质是_____ ,该反应的化学方程式是__________ 。
已知孔雀石的主要成分为Cu2(OH)2CO3,还含少量FeO、SiO2。现以孔雀石为原料制备CuSO4·5H2O。
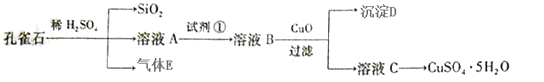
(1)实验步骤中试剂①最佳选择 (填代号);
a.H2O2 b.Cl2 c.KMnO4 d.HNO3
请写出其对应的离子方程式 。
(2)溶液B中加入CuO作用是 。
(3)由溶液C获得CuSO4·5H2O晶体,需要经___________、____________和过滤。
(4)25 ℃,Fe(OH)3的Ksp=1×10-38,若要将溶液中的Fe3+沉淀完全,必需调节溶液pH> 。
(5)实验室用惰性电极电解500ml的CuSO4溶液一段时间后,撤去电源,若加入0.2mol Cu(OH)2恰好使电解液恢复到原来状态,则电解过程中转移电子的物质的量为__________mol,原CuSO4溶液的物质的量浓度为________mol·L-1。
已知2SO2(g)+O2(g) 2SO3(g) ΔH=-a kJ/mol (a>0),在一个装有催化剂的2L的密闭容器中加入2 mol SO2和1 mol O2,在T ℃时充分反应,10s后达平衡状态,测得容器内气体压强为起始压强的5/6,放出热量为b kJ。
2SO3(g) ΔH=-a kJ/mol (a>0),在一个装有催化剂的2L的密闭容器中加入2 mol SO2和1 mol O2,在T ℃时充分反应,10s后达平衡状态,测得容器内气体压强为起始压强的5/6,放出热量为b kJ。
(1)计算:10s内该反应的平均速率v(O2)=______________,平衡常数K=______________。
(2)比较a b(填“>”“=”或“<”,下同),已知T1 ℃时,该反应的平衡常数K=16,由此可推知, T1___________T。
(3)若在原来的容器中,只加入2 mol SO3,T ℃时充分反应达平衡后, 吸收热量为c kJ,则a、b、c之间满足何种关系 (用代数式表示)。
(4)若相同条件下,向上述容器中分别通入x mol SO2 (g)、y mol O2 (g)、z mol SO3 (g),欲使达到新平衡时容器内气体压强仍为起始压强的5/6。
①x、y、z必须满足的关系是 、 ;
②欲使起始时反应表现为向正反应方向进行,则x的取值范围是 。
(5)将上述容器改为恒压容器(反应前体积相同),起始时加入2 mol SO2和1 mol O2,T ℃时充分反应达平衡后,放出热量为d kJ,则d b(填“>”“=”或“<”)。