室温下某强酸溶液pH=a,某强碱溶液pH=b,已知a+b=12,酸碱溶液混合后pH=7,则酸溶液体积V(酸)和碱溶液体积V(碱)的正确关系为( )
| A.V(碱)=V(酸) | B.V(酸)=100V(碱) |
| C.V(碱)=100V(酸) | D.V(碱)=1000V(酸) |
下列有关说法正确的是( )
| A.AlCl3溶液蒸干、灼烧至恒重,最终剩余固体是AlCl3 |
| B.在含有BaSO4沉淀的溶液中加入Na2SO4固体,c(Ba2+)增大 |
| C.将纯水加热至较高温度,KW变大、pH变小、呈酸性 |
| D.锅炉中沉积的CaSO4可用饱和Na2CO3溶液浸泡,再将不溶物用稀盐酸溶解除去 |
室温下,下列各组离子在有限定条件的溶液中一定能大量共存的是( )
| A.由水电离产生的c(H+)=10﹣12 mol•L一1的溶液中:K+、Na+、Fe2+、NO3﹣ |
| B.室温下,pH=7的溶液中:Al3+、Cl﹣、HCO3﹣、SO42﹣ |
| C.室温下,pH=13的溶液中:K+、Cu2+、S2﹣、Cl﹣ |
| D.pH=13的溶液中:K+、Ba2+、Cl﹣、OH﹣ |
室温下,向10mLpH=3的醋酸溶液中加水稀释后,下列说法正确的是( )
| A.溶液中导电粒子的数目减少 |
| B.溶液中c(OH-)增大 |
| C.醋酸的电离程度增大,c(H+)亦增大 |
| D.再加入10mLpH=11的NaOH溶液,混合液的pH=7 |
水是最宝贵的资源之一。下列表述正确的是( )
| A.4℃时,纯水的pH=7 |
| B.温度升高,纯水中的c(H+) 增大,c(OH﹣)减小 |
| C.水的电离程度很小,纯水中主要存在形态是水分子 |
| D.向水中加入酸或碱,都可抑制水的电离,使水的离子积减小 |
在新制饱和氯水中,若只改变某一条件,下列叙述正确的是
| A.再通入少量氯气,c(H+)/c(ClO-)减小 |
| B.加入少量的碳酸钠粉末,pH增大,溶液漂白性增强 |
| C.加入少量固体NaOH,一定有c(Na+)=c( Cl-)+c(ClO-) |
| D.加入少量水,水的电离平衡向逆反应方向移动 |
有A、B两种短周期主族元素,原子半径是:r(A)<r(B),且A、B两种元素原子的最外层电子数相同(选项中的m、n均为正整数),下列说法正确的是
A.若B(OH)m 是强碱,则A(OH)m一定为强碱
B.若HnAOm是强酸,则B的最高价氧化物对应的水化物一定为强酸
C.若B是金属,则A可能是非金属,若B是非金属,则A不可能是金属
D.若HnAOm是强酸,则A元素的氢化物的水溶液一定显酸性
下列装置能达到相应实验目的是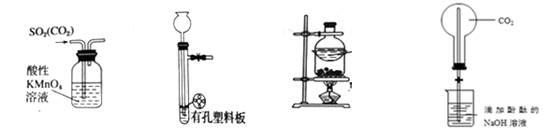
| A.甲装置,除去SO2中混有的CO2 |
| B.乙装置,用于亚硫酸钠和硫酸反应制取少量的SO2 |
| C.丙装置,分离NH4Cl和Ca(OH)2固体 |
| D.丁装置, 做喷泉实验 |
甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下转化关系: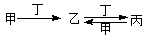 。下列有关物质的推断不正确的是
。下列有关物质的推断不正确的是
| A.若甲为焦炭,则丁可能是O2 |
| B.若甲为SO2,则丁可能是氨水 |
| C.若甲为Fe,则丁可能是盐酸 |
| D.若甲为NaOH溶液,则丁可能是CO2 |
下列有关反应热的说法正确的是
| A.在化学反应过程中,吸热反应需不断从外界获得能量,放热反应不需从外界获得能量 |
| B.甲烷的标准燃烧热△H=﹣890kJ/mol,则甲烷燃烧的热化学方程式为CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=﹣890kJ•mol﹣1 |
| C.已知常温常压下HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l)△H=﹣57.3 kJ•mol﹣1,则有H2SO4(aq)+Ba(OH)2(aq)=BaSO4(s)+2H2O(l)△H=﹣114.6 kJ•mol﹣1 |
| D.已知S(s)+O2(g)=SO2(g)△H1=﹣Q1 kJ•mol﹣1,S(g)+O2(g)=SO2(g)△H2=﹣Q2kJ•mol﹣1,则Q1<Q2 |
已知W、X、Y、Z为原子序数依次增大的短周期主族元素,X、Y、Z同周期,W、Z同主族,其中X、Y为金属元素,W与Y的原子序数相差5,下列说法正确的是
| A.X离子的氧化性大于Y离子 |
| B.W的气态氢化物的稳定性比Z的弱 |
| C.含Y的盐溶液一定显酸性 |
| D.X离子的半径小于W离子 |
设NA为阿伏伽德罗常数的值,下列说法正确的是
| A.10mL 18mol/L浓硫酸与足量铜加热充分反应,其中有0.09NA个H2SO4体现了氧化性 |
| B.33.6LCl2一定能与56g铁在加热条件下发生反应 |
| C.12.0g熔融的NaHSO4中含有的阳离子数为0.2NA |
| D.在反应14CuSO4+5FeS2+12H2O═7Cu2S+5FeSO4+12H2SO4中,5molFeS2发生反应,有21NA个电子发生转移 |
下列说法正确的是
| A.分子内共价键越强,分子越稳定,其熔、沸点也越高 |
| B.共价化合物溶于水,分子内共价键一定被破坏 |
| C.离子键的形成一定有电子的得与失 |
| D.分子晶体中一定存在分子间作用力,不一定存在共价键 |