报道,科学家已成功合成了少量N4,有关N4的说法正确的是
| A.N4和N2是互为同位素 |
| B.N4的摩尔质量是56g |
| C.相同质量的N4和N2所含原子个数比为2:1 |
| D.每个N4分子含有28个电子 |
CO2、Fe2O3、Na2SO4溶液、Ba(OH)2溶液、盐酸五种物质,在常温下两种物质间能发生的化学反应有
| A.3个 | B.4个 | C.5个 | D.6个 |
下列物质中含分子数最多的是
| A.标准状况下72mL水 | B.80g CO2 |
| C.标准状况下44.8L氨气 | D.3.01×1023个氢分子 |
下列有关 、
、 、
、 说法错误的是
说法错误的是
| A.是碳元素的三种同位素 |
| B.是不同的原子 |
| C.化学性质完全不同 |
| D.其中的 14C和14N所含的质量数相等 |
下列各组物质的转化,只通过一步反应不能完成的是
| A.BaCl2→NaCl | B.KMnO4→MnO2 |
| C.Na2CO3→NaOH | D.CuO→Cu(OH)2 |
下列各组物质按酸、碱、盐、电解质分类顺序排列的是
| A.硫酸、纯碱、明矾、二氧化硫 |
| B.硝酸、烧碱、碳酸钙、氯化钠 |
| C.醋酸、苛性钠、碳酸钠、氨水 |
| D.盐酸、熟石灰、苛性钠、乙醇 |
下列对于胶体说法错误的是
| A.用丁达尔效应区别溶液与胶体 |
| B.橄榄油溶于水形成的液体,能发生丁达尔效应 |
| C.Al(OH)3胶体可以用来净水,是因为胶体有吸附性 |
| D.胶体区别于其他分散系的本质是分散质粒子直径在10-9m ~ 10-7m |
硝基苯甲酸乙酯在OH-存在下发生水解反应:
O2NC6H4COOC2H5+OH- O2NC6H4COO-+C2H5OH
O2NC6H4COO-+C2H5OH
两种反应物的初始浓度均为0.050 mol·L-1,15 ℃时测得O2NC6H4COOC2H5的浓度c随时间变化的数据如表所示。回答下列问题:
| t/s |
0 |
120 |
180 |
240 |
330 |
530 |
600 |
700 |
800 |
| c/mol·L-1 |
0 |
0.036 |
0.030 |
0.026 |
0.022 |
0.017 |
0.016 |
0.015 |
0.015 |
(1)计算该反应在120~180 s间的平均反应速率_________;比较120~180 s与180~240 s 区间的平均反应速率的大小,前者_________后者(填>,<或=),理由是____________________。
(2)计算15 ℃时该反应的平衡常数_____________。
(3)为提高O2NC6H4COOC2H5的平衡转化率,除可适当控制反应温度外,还可采取的措施有________。
A.加入O2NC6H4COOC2H5 B.增加OH-的浓度
C.移去产物 D.加入适当的催化剂
电化学原理在化学工业中有广泛的应用.请根据如图回答问题:
(1)装置Ⅰ中的X电极的名称是 ,Y电极的电极反应式为 ,工作一段时间后,电解液的PH将 (填“增大”、“减小”、“不变”).
(2)若装置Ⅱ中a、b均为Pt电极,W为饱和食盐水(滴有几滴酚酞),实验开始后,观察到b电极周围溶液变红色,其原因是(用电极反应式表示) ,a电极上有气泡产生,该气体的电子式为 .
(3)若利用装置Ⅱ进行铜的精炼,则a电极的材料为 ,工作一段时间后装置Ⅱ电解液中c(Cu2+)将 (填“增大”、“减小”、“不变”).
(4)若装置Ⅱ中a为Ag棒,b为铜棒,W为AgNO3溶液,工作一段时间后发现铜棒增重2.1.6g,则流经电路的电子的物质的量为 .
已知反应①:CO(g)+CuO(s) 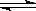 CO2(g)+Cu(s)和反应②:H2(g)+CuO(s)
CO2(g)+Cu(s)和反应②:H2(g)+CuO(s) 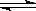 Cu(s)+H2O(g)在相同的某温度下的平衡常数分别为K1和K2,该温度下反应③:CO(g)+H2O(g)
Cu(s)+H2O(g)在相同的某温度下的平衡常数分别为K1和K2,该温度下反应③:CO(g)+H2O(g) 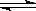 CO2(g)+H2(g)的平衡常数为K。则下列说法正确的是
CO2(g)+H2(g)的平衡常数为K。则下列说法正确的是
A.反应①的平衡常数K1=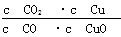 |
B.反应③的平衡常数K=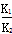 |
| C.对于反应③,恒容时,温度升高,H2浓度减小,则该反应的△H>0 |
| D.对于反应③,恒温恒容下,增大压强,H2浓度一定减小 |
右图表示298K时N2与H2反应过程中的能量变化。根据右图叙述正确的是
A.该反应的热化学方程式为 N2(g)+ N2(g)+  H2(g) H2(g) NH3(g),△H=-92kJ·mol-1 NH3(g),△H=-92kJ·mol-1 |
| B.不用催化剂,生成 1molNH3放出的热量为46 KJ |
| C.加入催化剂,生成 1molNH3的反应热减小50 KJ·mol-1 |
| D.曲线b表明加入催化剂降低了反应热,加快了反应速率 |
用惰性电极电解足量下列溶液,一段时间后,再加入一定质量的另一种物质(括号内),溶液能与原来溶液完全一样的是
| A.CuCl2 [CuCl2溶液] | B.NaOH [NaOH溶液] |
| C.NaCl [HCl气体] | D.CuSO4 [Cu(OH)2] |
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:3Zn+2K2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3+4KOH。下列叙述不正确的是
3Zn(OH)2+2Fe(OH)3+4KOH。下列叙述不正确的是
| A.放电时负极反应为:3Zn-6e-+6OH-==3Zn(OH)2 |
B.充电时阳极反应为:Fe(OH)3-3e-+5OH- FeO42- +4H2O FeO42- +4H2O |
| C.放电时每转移3 mol电子,正极有1 mol K2FeO4被还原 |
| D.充电时阴极溶液的碱性减弱 |
乙苯催化脱氢制苯乙烯反应:

已知:1 mol C-H键完全断裂时吸收热量412kJ,1 mol C-C键完全断裂时吸收热量348kJ
1 mol C=C键完全断裂吸收热量612kJ,1 mol H-H键完全断裂时吸收热量436kJ。
上述反应的△H等于 kJ·mol-1。
| A.-124 | B.+124 | C.-288 | D.+288 |
下列说法正确的是:
| A.甲烷的标准燃烧热为-890.3 kJ·mol-1,则甲烷燃烧的热化学方程式表示为: CH4(g)+2O2(g)=CO2(g)+2H2O(g)ΔH=-890.3 kJ·mol-1 |
B.500 ℃、30 Mpa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)  2NH3(g)ΔH=-38.6kJ·mol-1 2NH3(g)ΔH=-38.6kJ·mol-1 |
| C.同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件的ΔH相同 |
| D.HCl和NaOH反应的中和热△H=﹣57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(﹣57.3)kJ/mol |