有a、b、c、d四种金属,将a与b用导线连接起来,浸入电解质溶液中,b不易腐蚀;将a、d分别投入等浓度的盐酸中,d比a反应剧烈;将铜浸入b盐溶液中,无明显变化;将铜浸入c的盐溶液中,有金属c析出。据此可推知它们的活动性顺序由强到弱为
| A.dcab | B.dbac | C.dabc | D.badc |
化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)出的能量。已知白磷和P4O6的分子结构如图所示,现提供以下化学键的键能(kJ·mol-1):P—P:198 P—O:360 O=O:498则反应 P4(白磷)+3O2= P4O6的反应热ΔH为

| A.-1638 kJ·mol-1 | B.+1638 kJ·mol-1 |
| C.-126 kJ·mol-1 | D.+126 kJ·mol-1 |
下列有关金属腐蚀与防护的说法正确的是
| A.钢柱在水下部分比在空气与水交界处更容易腐蚀 |
| B.当镀锡铁制品的镀层破损时,镀层仍能对铁制品起保护作用 |
| C.在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法 |
| D.可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀 |
化学反应A2(g)+B2(g)═2AB(g)的能量变化如图所示,下列叙述中正确的是
| A.每生成2个分子AB吸收(a﹣b) kJ热量 |
| B.该反应热△H=+(a﹣b)kJ·mol﹣1 |
| C.该反应中反应物的总能量高于生成物的总能量 |
| D.断裂1mol A﹣A和1mol B﹣B键,放出a kJ能量 |
在下列各说法中,正确的是
| A.ΔH > 0表示放热反应,ΔH < 0表示吸热反应 |
| B.1 mol H2与0.5 mol O2反应的焓变就是H2的燃烧热 |
| C.1 mol H2SO4与1 mol Ba(OH)2反应生成BaSO4沉淀的焓变叫做中和热 |
| D.热化学方程式中的化学计量数表示物质的量,可以是分数 |
为测定某石灰石样品的纯度,称取4.5g石灰石,加入未知浓度的盐酸直到不再产生气体(杂质不与盐酸反应),消耗盐酸50mL,生成二氧化碳气体896mL(标准状况)。
求(1)盐酸的物质的量浓度
(2)石灰石样品的纯度(用百分数表示且保留小数点后一位)
下图表示配制一定物质的量浓度溶液的几个关键实验步骤和操作,现欲配制230 mL 0.100 mol·L-1 Na2CO3溶液,回答下列问题:
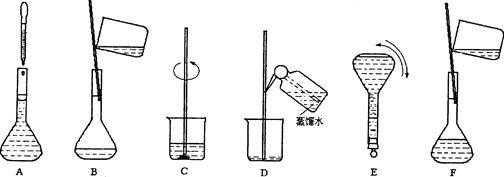
(1)若用Na2CO3.10H2O来配制溶液,需选择________的容量瓶,用天平称取晶体 克。若所取的晶体已经有一部分失去了结晶水,则所配制的溶液浓度 (填偏大、偏小或无影响)。
(2)步骤B通常称为转移,玻璃棒的作用是 ______;步骤A通常称为 ,此时应注意视线与___________、___________水平相切,如果俯视刻度线,配制的浓度_____ (填偏大、偏小或无影响);步骤结束后发现液面低于刻度线,则配制的浓度 (填偏大、偏小或无影响)。
(3)将上述实验步骤A—F按实验过程先后次序排列 。
(4)下列关于容量瓶使用的说法正确的是
| A.使用前须干燥 |
| B.使用前先检查瓶塞不漏水 |
| C.配好的溶液可以贮存在容量瓶中 |
| D.热溶液须冷却至室温才能转移入容量瓶 |
E.容量瓶用于准确配制任意体积的一定物质的量浓度的溶液
(1)已知AR2-电子数为18,则R的中子数为____________。
(2)在标准状况下,8.96L的H2X气体含有a个氢原子,则阿伏加德罗常数可表示为___________(用含a的式子表示);若其质量为13.6g ,则X的相对原子质量为___________。
(3)含13.8g Na+ 的Na3PO4溶液100mL,PO43-的物质的量浓度为___________,取出1mL,Na3PO4的物质的量浓度为_____________。
现有H 、C、O、Na 四种元素,按要求完成下列各小题。
(1)写出Na+的结构示意图____________________。
(2)已知O元素的一种核素,其中子数比电子数多2,该核素可表示为:___________。
(3)A、B、C是由上述一种或几种元素组成的物质,且能实现A + B → C + H2O的转化,按要求写出化学反应方程式,并注明反应条件。
①酸性氧化物 → 盐:_________________________
②属于氧化还原反应:_________________________
(4)任写一种含上述三种元素 的非电解质________________;(填名称)上述四种元素组成的物质X可用于治疗胃酸(盐酸)过多,相应的化学方程式为_____________________________。
选择合适的装置分离提纯下列物质,将装置序号填入表格:

① ② ③ ④
| 题号 |
混合物 |
方法 |
| (1) |
海水中提取饮用水 |
__________ |
| (2) |
提取碘水中的碘 |
__________ |
| (3) |
分离MnO2和NaCl固体混合物 |
溶解、 、洗涤______ |
某无色溶液进行如下操作,结论正确的是
| |
操作 |
现象 |
结论 |
| A |
滴加稀盐酸 |
有气泡产生 |
原溶液中有CO32- |
| B |
滴加盐酸酸化的 BaCl2溶液 |
生成白色沉淀 |
原溶液中有Ag+ 或SO42- |
| C |
用洁净铂丝蘸取溶液 进行灼烧 |
火焰呈黄色 |
原溶液中有Na+、 无K+ |
| D |
滴加稀NaOH溶液,将湿 润红色石蕊试纸置于试管口 |
试纸不变蓝 |
原溶液中无NH4+ |
NA表示阿伏加德罗常数的数值,下列说法正确的是
| A.2mol氖气中含有2NA个原子 |
| B.24g Mg失去NA个电子形成Mg2+ |
| C.标准状况下11.2L的H2O中含有0.5 NA个分子 |
| D.22.4LCO2含有2NA个氧原子 |
在盛有碘水的试管中,加入少量CCl4后振荡,静置片刻后
| A.整个溶液变紫色 | B.整个溶液变为棕黄色 |
| C.上层褪色,下层为紫红色 | D.下层褪色,上层紫红色 |