用下列装置能达到有关实验目的的是( )

| A.除去CO中的CO2气体 | B.制备Fe(OH)2 |
| C.制备氨气 | D.比较NaHCO3和Na2CO3的热稳定性 |
一定条件下,下列各组物质中,Y既能与X反应又能与Z反应的是( )
| |
X |
Y |
Z |
| ① |
NaOH溶液 |
Al |
Fe2O3 |
| ② |
KOH溶液 |
Br2 |
Na2SO3溶液 |
| ③ |
Na2CO3 |
SiO2 |
H2O |
| ④ |
HCl |
NaHCO3 |
NaOH |
A.只有①③④ B.只有①②④ C.只有①②③ D.①②③④皆可
下列认识正确的是( )
| A.H2与D2、T2互为同位素 |
| B.氯化钠溶液和氢氧化铁胶体可以用过滤的方法分离 |
| C.NH3溶于水可以导电,但不是电解质 |
| D.SO2、NO2均属于酸性氧化物 |
某溶液中含有HCO3-、SO42-、Na+、SO32-、NO3-、Cl-六种离子。若向其中加入过氧化钠粉末充分反应后(溶液体积变化忽略不计),溶液中离子浓度保持不变的是( )
| A.SO42-、NO3- | B.NO3-、Cl- | C.SO32-、NO3- | D.Cl-、NO3-、Na+ |
已知溶液中存在较大量的H+、SO42-、NO3-,则该溶液中还能大量共存的离子组为( )
| A.Na+、CH3COO-、NH4+ | B.Mg2+、Ba2+、Br- |
| C.Cu2+、Cl-、I- | D.K+、Cl-、Mg2+ |
为了研究影响化学反应速率的因素,甲、乙、丙、丁四位学生分别设计了如下四个实验,你认为不正确的是
| A.100 mL 2 mol·L-1的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速率不变 |
| B.将相同大小、形状的铝条与稀硫酸和浓硫酸反应时,稀硫酸产生氢气快 |
| C.将氢气和氯气的混合气体分别放在冷暗处和强光照射下,会发现光照下有氯化氢生成 |
| D.两支试管中分别加入相同浓度相同体积的双氧水,其中一支试管再加入少量二氧化锰,产生氧气的快慢不同 |
将2 mol X和2 mol Y充入2 L密闭容器中发生如下反应:X(g)+3Y(g) 2Z(g)+a Q(g)
2Z(g)+a Q(g)
达到平衡时生成0.8 mol Z,测得Q的浓度为0.4 mol/L,下列叙述错误的是
| A.a的值为2 | B.平衡时X的浓度为0.2 mol/L |
| C.平衡时Y的转化率为60% | D.平衡时Z的体积百分含量为20% |
在温度体积不变的条件下发生反应:NO2(g)+SO2(g) SO3(g)+NO(g)将NO2与SO2以体积比3:1置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是
SO3(g)+NO(g)将NO2与SO2以体积比3:1置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是
| A.混合气体密度保持不变 |
| B.体系压强保持不变 |
| C.SO2和NO的体积比保持不变 |
| D.每消耗1mol SO2的同时生成1molNO |
下列说法正确的是
| A.增大压强,活化分子百分数增多,化学反应速率一定增大 |
| B.升高温度,活化分子百分数不变,化学反应速率一定增大 |
| C.加入反应物,使活化分子百分数增大,化学反应速率增大 |
| D.使用催化剂,降低了反应的活化能,增大了活化分子百分数,化学反应速率一定增大 |
实验室用4 mol SO2与2 mol O2在一定条件下进行下列反应:2SO2(g)+O2(g)  2SO3(g) ΔH=-196.64 kJ/mol,当放出314.624 kJ热量时,SO2的转化率为
2SO3(g) ΔH=-196.64 kJ/mol,当放出314.624 kJ热量时,SO2的转化率为
| A.40% | B.50% | C.80% | D.90% |
用纯净的CaCO3与稀盐酸反应制取CO2,实验过程记录如图所示。根据分析、判断,正确的是 
| A.OE段表示反应速率最快 |
| B.EF段表示反应速率最快,单位时间内收集的CO2最多 |
| C.FG段表示收集的CO2最多 |
| D.OG段表示随着时间的推移,反应速率逐渐增快 |
在2 L容器中发生3A+B 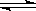 2C的反应,最初加入的A、B都是4 mol,若10 s 后反应达到平衡,测得A的平均反应速率为0.15 mol·L-1·s-1,则10 s后容器内B的物质的量为
2C的反应,最初加入的A、B都是4 mol,若10 s 后反应达到平衡,测得A的平均反应速率为0.15 mol·L-1·s-1,则10 s后容器内B的物质的量为
A.1.5 mol B.1.0 mol C.3.0 mol D.2.4 mol
按图甲装置进行实验,若图乙中横坐标x表示通过电极的电子的物质的量。下列叙述正确的是
| A.F表示反应生成Cu的物质的量 |
| B.E表示反应生成O2的物质的量 |
| C.E表示反应实际消耗H2O的物质的量 |
| D.F表示反应生成H2SO4的物质的量 |
已知外电路中,电子由铜流向a极。有关下图中装置分析合理的一项是
| A.一段时间后锌片质量减少 |
| B.该装之中Cu极为正极 |
| C.b极的电极反应式:H2—2e—=2H+ |
| D.当铜片的质量变化为12.8g时,a极上消耗的 O2在标况下的体积为2.24L |