浙江省温州十校联合体高二上学期期中测试化学试卷
下列说法不正确的是
| A.开发氢能、太阳能、风能、生物质能等是实现“低碳生活”的有效途径 |
| B.废旧电池不能随意丢弃,要进行深埋处理,防止重金属污染 |
| C.“冰,水为之,而寒于水”说明相同质量的水和冰,水的能量高 |
| D.使用分光光度计,可以换算得到某溶液的浓度 |
下列装置中,都伴随有能量变化,其中是由化学能转变为电能的是
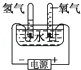
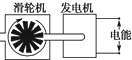


| A.电解水 | B.水力发电 | C.太阳能热水器 | D.干电池 |
把下列四种X溶液分别加入四个盛有10mL 2mol/L盐酸的烧杯中,均加水稀释到50mL,此时,X和盐酸缓慢地进行反应,其中反应最快的是
| A.10℃20mL 3mol/L的X溶液 | B.20℃30mL 2mol/L的X溶液 |
| C.20℃10mL 4mol/L的X溶液 | D.10℃10mL 2mol/L的X溶液 |
2008年,美籍华裔科学家钱永健获得2008年度诺贝尔化学奖。16岁时,他凭借一个金属易受硫氰酸盐腐蚀的调查项目,荣获“美国西屋天才奖”。下列叙述正确的是
| A.金属腐蚀就是金属失去电子被还原的过程 |
| B.水库中的水闸(钢板)与外加直流电源的负极相连,正极连接到一块废铁上可防止水闸被腐蚀 |
| C.纯银质物品久置表面变暗,是银发生吸氧腐蚀的结果 |
| D.钢板上的铁铆钉处在潮湿的空气中直接发生反应:Fe-3e-==Fe3+,继而形成铁锈 |
利用下图所示装置,当X、Y选用不同材料时,可将电解原理广泛应用于工业生产。下列说法中正确的是
| A.氯碱工业中,X、Y均为石墨,X附近能得到氢氧化钠 |
| B.铜的精炼中,X是纯铜,Y是粗铜,Z是CuSO4 |
| C.电镀工业中,X是待镀金属,Y是镀层金属 |
| D.外加电流的阴极保护法中,Y是待保护金属 |
下列说法正确的是
A.已知氯化钴及其水合物会呈现不同颜色(如下),德国科学家发明了添加氯化钴的变色水泥,据此推测雨天变色水泥呈粉红色 |
| B.有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增大活化分子的百分数,从而使反应速率增大 |
| C.2CO(g)=N2(g)+2CO2(g)在常温下能自发进行,则该反应的ΔH>0 |
| D.对于乙酸与乙醇的酯化反应(ΔH<0),加入少量浓硫酸并加热,该反应的反应速率和平衡常数均增大 |
下列说法正确的是:
| A.甲烷的标准燃烧热为-890.3 kJ·mol-1,则甲烷燃烧的热化学方程式表示为: CH4(g)+2O2(g)=CO2(g)+2H2O(g)ΔH=-890.3 kJ·mol-1 |
B.500 ℃、30 Mpa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)  2NH3(g)ΔH=-38.6kJ·mol-1 2NH3(g)ΔH=-38.6kJ·mol-1 |
| C.同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件的ΔH相同 |
| D.HCl和NaOH反应的中和热△H=﹣57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(﹣57.3)kJ/mol |
对于已经达到平衡的可逆反应,下列物理量的变化可以肯定可逆反应平衡发生了移动的是
| A.浓度变化 | B.压强变化 | C.体积变化 | D.转化率变化 |
已知某可逆反应 mA(g)+nB(g)  pC(g) △H=QkJ·mol-1,在密闭容器中进行,下图表示在不同时间t、温度T、压强P与反应物B的百分含量的关系曲线,下列判断正确是
pC(g) △H=QkJ·mol-1,在密闭容器中进行,下图表示在不同时间t、温度T、压强P与反应物B的百分含量的关系曲线,下列判断正确是

| A.T2 >T1,P1 > P2 ,m+n > p,ΔΗ<0 |
| B.T1 >T2,P1 < P2 ,m+n < p,ΔΗ>0 |
| C.T1 <T2,P1 < P2,m+n < p,ΔΗ<0 |
| D.T1 >T2,P1 < P2,m+n > p,ΔΗ>0 |
在进行中和反应的反应热测定的实验中不需要用到的仪器是
| A.天平 | B.温度计 | C.环形玻璃搅拌棒 | D.量筒 |
下列事实不能用勒沙特列原理解释的是
| A.氯化镁溶液加热蒸干最终得不到氯化镁固体; |
| B.实验室可用排饱和食盐水的方法收集氯气; |
| C.开启啤酒瓶后,瓶中马上泛起大量泡沫 |
| D.压缩氢气与碘蒸气反应的平衡混合气体,颜色变深. |
将BaO2放入密闭的真空容器中,反应2BaO2(s)  2BaO(s)+O2(g)达到平衡。保持温度不变,缩小容器容积,体系重新达到平衡,下列说法正确的是
2BaO(s)+O2(g)达到平衡。保持温度不变,缩小容器容积,体系重新达到平衡,下列说法正确的是
| A.平衡常数减小 | B.BaO量不变 |
| C.氧气浓度不变 | D.平衡向右移动 |
乙苯催化脱氢制苯乙烯反应:

已知:1 mol C-H键完全断裂时吸收热量412kJ,1 mol C-C键完全断裂时吸收热量348kJ
1 mol C=C键完全断裂吸收热量612kJ,1 mol H-H键完全断裂时吸收热量436kJ。
上述反应的△H等于 kJ·mol-1。
| A.-124 | B.+124 | C.-288 | D.+288 |
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:3Zn+2K2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3+4KOH。下列叙述不正确的是
3Zn(OH)2+2Fe(OH)3+4KOH。下列叙述不正确的是
| A.放电时负极反应为:3Zn-6e-+6OH-==3Zn(OH)2 |
B.充电时阳极反应为:Fe(OH)3-3e-+5OH- FeO42- +4H2O FeO42- +4H2O |
| C.放电时每转移3 mol电子,正极有1 mol K2FeO4被还原 |
| D.充电时阴极溶液的碱性减弱 |
用惰性电极电解足量下列溶液,一段时间后,再加入一定质量的另一种物质(括号内),溶液能与原来溶液完全一样的是
| A.CuCl2 [CuCl2溶液] | B.NaOH [NaOH溶液] |
| C.NaCl [HCl气体] | D.CuSO4 [Cu(OH)2] |
右图表示298K时N2与H2反应过程中的能量变化。根据右图叙述正确的是
A.该反应的热化学方程式为 N2(g)+ N2(g)+  H2(g) H2(g) NH3(g),△H=-92kJ·mol-1 NH3(g),△H=-92kJ·mol-1 |
| B.不用催化剂,生成 1molNH3放出的热量为46 KJ |
| C.加入催化剂,生成 1molNH3的反应热减小50 KJ·mol-1 |
| D.曲线b表明加入催化剂降低了反应热,加快了反应速率 |
一个固定体积的密闭容器中,加入2molA和1molB,发生反应2A(g)+B(g)  3C(g)+D(s),达到平衡时,C的浓度为ω mol/L。若维持容器体积和温度不变,改由下列四种配比作为起始物质,达到平衡时,C的浓度仍为ω mol/L的是
3C(g)+D(s),达到平衡时,C的浓度为ω mol/L。若维持容器体积和温度不变,改由下列四种配比作为起始物质,达到平衡时,C的浓度仍为ω mol/L的是
| A.4molA+2molB | B.3molC+2molD |
| C.1molB+3molC+1molD | D.2molA+1molB+3molC+1molD |
一定温度下,在2L的密闭容器中发生如下反应:A(s)+2B(g) xC(g)△H<0,B、C的物质的量随时间变化的关系如图1,达平衡后在t1、t2、t3、t4时都只改变了一种条件,逆反应速率随时问变化的关系如图2.
xC(g)△H<0,B、C的物质的量随时间变化的关系如图1,达平衡后在t1、t2、t3、t4时都只改变了一种条件,逆反应速率随时问变化的关系如图2.
下列有关说法中正确的是
A.x=2,反应开始2 min内,v(A)=0.05mol•L﹣1•min﹣1
B.t1时改变的条件是降温,平衡逆向移动
C.t2时改变的条件可能是增大C的浓度,t2时正反应速率减小
D.t3时可能是减小压强,平衡不移动;t4时可能是使用催化剂,c(B)不变
已知反应①:CO(g)+CuO(s) 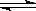 CO2(g)+Cu(s)和反应②:H2(g)+CuO(s)
CO2(g)+Cu(s)和反应②:H2(g)+CuO(s) 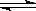 Cu(s)+H2O(g)在相同的某温度下的平衡常数分别为K1和K2,该温度下反应③:CO(g)+H2O(g)
Cu(s)+H2O(g)在相同的某温度下的平衡常数分别为K1和K2,该温度下反应③:CO(g)+H2O(g) 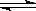 CO2(g)+H2(g)的平衡常数为K。则下列说法正确的是
CO2(g)+H2(g)的平衡常数为K。则下列说法正确的是
A.反应①的平衡常数K1=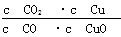 |
B.反应③的平衡常数K=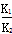 |
| C.对于反应③,恒容时,温度升高,H2浓度减小,则该反应的△H>0 |
| D.对于反应③,恒温恒容下,增大压强,H2浓度一定减小 |
用惰性电极电解一定量的硫酸铜溶液,电解过程中的实验数据如图所示.横坐标表示转移电子的物质的量,纵坐标表示电解过程中产生气体的总体积(标准状况).下列判断正确的是
| A.电解过程中,溶液的H+浓度不断减小 |
| B.当转移0.4mol e﹣时,电解生成的铜为6.4g |
| C.阳极电极反应式为2H2O+4e﹣=4H++O2↑ |
| D.Q点对应的气体中,H2与O2的体积比为2:1 |
(1)化学键的键能是指气态原子间形成1 mol化学键时释放的能量。下表列出了某些化学键的键能:

| 化学键 |
H—H |
O==O |
O—H |
| 键能(kJ·mol-1) |
436 |
x |
463 |
请回答下列问题:
①如图表示某反应的能量变化关系图,此反应为 (填 “放热”或“吸热”)反应,其中ΔH= kJ·mol-1(用含C和D的字母表示)。
②若此能量变化关系图表示反应H2(g)+1/2O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1,则B= kJ·mol-1,x=
(2)①火箭发射常以液态肼(N2H4)为燃料,液态过氧化氢为助燃剂。已知:
N2H4(l)+O2(g)=N2(g)+2H2O(g),ΔH=-534 kJ·mol-1
H2O2(l)=H2O(l)+ O2(g),ΔH=-98 kJ·mol-1
O2(g),ΔH=-98 kJ·mol-1
H2O(l)=H2O(g),ΔH=+44 kJ·mol-1
试写出N2H4和液态H2O2反应生成气态水的热化学方程式___________________。
②肼(N2H4)—空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。该电池放电时,负极的电极反应式是_____________________。
电化学原理在化学工业中有广泛的应用.请根据如图回答问题:
(1)装置Ⅰ中的X电极的名称是 ,Y电极的电极反应式为 ,工作一段时间后,电解液的PH将 (填“增大”、“减小”、“不变”).
(2)若装置Ⅱ中a、b均为Pt电极,W为饱和食盐水(滴有几滴酚酞),实验开始后,观察到b电极周围溶液变红色,其原因是(用电极反应式表示) ,a电极上有气泡产生,该气体的电子式为 .
(3)若利用装置Ⅱ进行铜的精炼,则a电极的材料为 ,工作一段时间后装置Ⅱ电解液中c(Cu2+)将 (填“增大”、“减小”、“不变”).
(4)若装置Ⅱ中a为Ag棒,b为铜棒,W为AgNO3溶液,工作一段时间后发现铜棒增重2.1.6g,则流经电路的电子的物质的量为 .
硝基苯甲酸乙酯在OH-存在下发生水解反应:
O2NC6H4COOC2H5+OH- O2NC6H4COO-+C2H5OH
O2NC6H4COO-+C2H5OH
两种反应物的初始浓度均为0.050 mol·L-1,15 ℃时测得O2NC6H4COOC2H5的浓度c随时间变化的数据如表所示。回答下列问题:
| t/s |
0 |
120 |
180 |
240 |
330 |
530 |
600 |
700 |
800 |
| c/mol·L-1 |
0 |
0.036 |
0.030 |
0.026 |
0.022 |
0.017 |
0.016 |
0.015 |
0.015 |
(1)计算该反应在120~180 s间的平均反应速率_________;比较120~180 s与180~240 s 区间的平均反应速率的大小,前者_________后者(填>,<或=),理由是____________________。
(2)计算15 ℃时该反应的平衡常数_____________。
(3)为提高O2NC6H4COOC2H5的平衡转化率,除可适当控制反应温度外,还可采取的措施有________。
A.加入O2NC6H4COOC2H5 B.增加OH-的浓度
C.移去产物 D.加入适当的催化剂
工厂使用石油热裂解的副产物甲烷来制取氢气,其生产流程如下图:
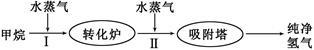
(1)此流程的第II步反应为:CO(g)+H2O(g) H2(g)+CO2(g),该反应的平衡常数随温度的变化如下表:
H2(g)+CO2(g),该反应的平衡常数随温度的变化如下表:
| 温度/℃ |
400 |
500 |
830 |
| 平衡常数K |
10 |
9 |
1 |
从上表可以推断:此反应是 (填“吸”或“放”)热反应。在830℃下,若开始时向恒容密闭容器中充入1mo1CO和2mo1H2O,则达到平衡后CO的转化率为 。
(2)在500℃,按照下表的物质的量(按照CO、H2O、H2、CO2的顺序)投入恒容密闭容器中进行上述第II步反应,达到平衡后下列关系正确的是 。
| 实验编号 |
反应物投入量 |
平衡时H2浓度 |
吸收或放出的热量 |
反应物转化率 |
| A |
1、1、0、0 |
c1 |
Q1 |
α1 |
| B |
0、0、2、2 |
c2 |
Q2 |
α2 |
| C |
2、2、0、0 |
c3 |
Q3 |
α3 |
A.2c1= c2 =c3 B.2Q1=Q2=Q3 C.α1 =α2 =α3 D.α1 +α2 =1
(3)在一个绝热等容容器中,不能判断此流程的第II步反应达到平衡的是 。
①v(CO2)正=v(H2O)逆
②混合气体的密度不变
③混合气体的平均相对分子质量不变 ④各组分的物质的量浓度不再改变
⑤体系的温度不再发生变化
(4)下图表示此流程的第II步反应,在t1时刻达到平衡、在t2时刻因改变某个条件使浓度发生变化的情况:图中t2时刻发生改变的条件是 、 (写出两种)。
若t4时刻通过改变容积的方法将压强增大为原先的两倍,在图中t4和t5区间内画出CO、CO2浓度变化曲线,并标明物质(假设各物质状态均保持不变)。

 粤公网安备 44130202000953号
粤公网安备 44130202000953号