下列说法正确的是
| A.吸热反应都需加热才能发生 |
| B.在铁制品上镀铜时,铁制品作阳极,铜盐溶液作电镀液 |
| C.应用盖斯定律,可计算某些难以直接测量的反应焓变 |
| D.密闭容器中进行的可逆反应,压强不发生变化时说明反应一定达到化学平衡状态 |
下列各组中,每种电解质溶液电解时只生成氢气和氧气的是
| A.NaOH、H2SO4、Ba(OH)2 | B.NaOH、CuSO4、H2SO4 |
| C.HCl、CuCl2、Ba(OH)2 | D.NaBr、H2SO4、Ba(OH)2 |
铁、铜单质及其化合物应用范围很广。现有含氯化亚铁杂质的氯化铜晶体(CuCl2·2H2O),为制取纯净的CuCl2·2H2O,首先将其制成水溶液,然后按如图步骤进行提纯:
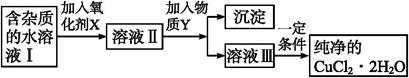
已知Cu2+、Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH,见下表:
| |
Fe3+ |
Fe2+ |
Cu2+ |
| 氢氧化物开始沉淀时的pH |
1.9 |
7.0 |
4.7 |
| 氢氧化物完全沉淀时的pH |
3.2 |
9.0 |
6.7 |
请回答下列问题:
(1)得到溶液II,需加入氧化剂X, 最适合作氧化剂X的是 (填编号,否则不给分)。
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
(2)加入氧化剂X的目的是 。
(3)为了除去Fe3+,需加入物质Y调节溶液的PH值为
(4)最后能不能直接蒸发结晶得到CuCl2·2H2O晶体? (填“能”或“不能”)。若能,不用回答;若不能,回答该如何操作? 。
(5)已知Fe(OH)3的Ksp=1×10-35mol4/L4;若Fe3+沉淀完全时,在溶液中Fe3+的浓度为1×10-5mol/L,则此时溶液的pH最小为 .
(1)氨的合成是最重要的化工生产之一,工业上合成氨用的H2有多种制取的方法。用天然气跟水蒸气反应:CH4(g)+H2O(g) CO(g)+3H2(g)。已知有关反应的能量变化如下图所示,则此制取H2反应的ΔH=____________。
CO(g)+3H2(g)。已知有关反应的能量变化如下图所示,则此制取H2反应的ΔH=____________。

(2)已知通常状况下,每充分燃烧1gCO并恢复到原状态,会释放10KJ的热量。请写出表示CO燃烧热的热化学反应方程式: 。
(3)一种甲烷燃料电池是采用铂或碳化钨作为电极催化剂,在稀硫酸电解液中直接通入甲烷,同时向一个电极通入空气。此电池的正极电极反应式是__________________。
(4)利用右图装置可以模拟铁的电化学防护。

①若X为碳棒,为减缓铁的腐蚀,开关K应置于 处。
假设海水中只有NaCl溶质,写出此时总离子反应方程式:
②若X为锌,开关K置于M处,该电化学防护法称为 。写出铁电极处的电极反应式:____________。
下列各组离子中,在给定条件下能大量共存的是
| A.在pH = 1的溶液中:NH4+、K+、ClO-、Cl- |
| B.有SiO32-存在的溶液中:Na+、Mg2+、Al3+、Cl- |
| C.有NO3-存在的强酸性溶液中:NH4+、Ba2+、Fe2+ 、Br- |
| D.在c(H+) = 1.0×10-13 mol·L-1的溶液中:Na+、S2-、AlO2-、SO32- |
臭氧是理想的烟气脱硝试剂,其脱硝反应为2NO2(g) + O3(g) N2O5(g) + O2(g),若反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是
N2O5(g) + O2(g),若反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是
| A |
B |
C |
D |
 |
 |
 |
 |
| 升高温度, 平衡常数减小 |
0~3 s内,反应速率为 v(NO2) =" 0.2" mol·L-1 |
t1时仅加入催化剂,平衡正向移动 |
达平衡时,仅改变x,则x为c(O2) |
右图是一款笔记本电脑所用甲醇燃料电池的结构示意图。

甲醇在催化剂作用下提供质子(H+)和电子,电子经外电路、质子经内电路到达另一极与氧气反应,电池总反应为:2CH3OH+3O2 = 2CO2+4H2O 下列说法正确的是( )
| A.右电极为电池的正极,b处通入的物质是空气 |
| B.左电极为电池的负极,a处通入的物质是空气 |
| C.正极反应式为:CH3OH+H2O-6e-= CO2+6H+ |
| D.正极反应式为:O2+2H2O+4e-=4OH- |
如图,A为直流电源,B为电解槽,c、d为石墨电极,B中存放有100mL NaCl和CuCl2的混合溶液,其中Cu2+的物质的量浓度为0.1mol/L,闭合K,d极收集到标准状况下448mL的一种气体甲,该气体能使湿润的碘化钾淀粉试纸变蓝。气体体积均
在标准状况下测定,假设溶液的体积变化忽略不计,不考虑
电解产生的气体溶解和吸收。请回答下列问题。

(1)A电源的a极是
(2)计算c极理论上收集到的气体的体积是 (标准状况下)。
(3)假设100mL溶液中,c(Cu2+)="a" mol/L,c(Na+)="b" mol/L,Cu2+完全放电后,理论上d极产生甲气体的体积V范围是 (用带a、b的代数式表示)。
下列各物质转化关系如图所示,A是一种高熔点固体,D是一种红棕色固体。
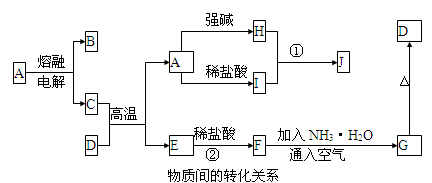
根据上述一系列关系回答:
(1)填写物质的化学式:B , G 。
(2)写出D物质中金属元素基态原子的核外电子排布图 。
(3)写出下列反应的离子方程式:
①H溶液和I溶液混合生成J___________ 。
②E和盐酸反应 。
(4)在电解熔融状态A的过程中,当电路中通过1mol电子时,阳极上产生的气体体积为 L。(标准状况下)
下图所示水槽中的试管内有一枚铁钉(含少量的炭),放置数天后观察:

(1)若试管内液面上升,则铁钉发生了 腐蚀,
正极反应式为 。
(2)若试管内的液面下降,则铁钉发生了 腐蚀,
负极反应式为 ,正极反应式为 。
下列关于溶液中离子的说法正确的是
| A.0.2 mol·L-1的Na2CO3溶液中离子浓度关系:c (Na+)="2c" (CO32-)+c (HCO3-)+c (H2CO3) |
| B.0.01 mol·L-1的NH4Cl和0.01 mol·L-1的NH3·H2O等体积混合后,若测得溶液中c (Cl-)>c (NH4+),则溶液中有关微粒的浓度关系:c (Cl-)>c (NH3·H2O)>c (NH4+)>c (H+)>c (OH-) |
| C.0.1 mol的NaHS和0.1 mol的NaHSO4混合溶于水,配制成1L溶液,则混合溶液中离子浓度关系为:c (Na+) - 0.1 mol·L-1=" 2c" (S2-) + c (H2S) + c (HS-) |
| D.0.1mol·L-1的NaHCO3溶液中离子浓度关系:c (OH-)="c" (H+)+c (H2CO3) - c (CO32-) |
下列离子方程式方程式中正确的是
A.NaHCO3溶液中HCO3-水解:HCO3-+ H2O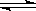 H2CO3+OH- H2CO3+OH- |
| B.AlCl3溶液中Al3+水解:Al3++3H2O = Al(OH)3↓+3H+ |
C.NaHS溶液中HS-水解:HS-+H2O 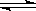 H3O++S2- H3O++S2- |
D.碳酸溶液中H2CO3的电离:H2CO3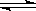 2H++ CO32- 2H++ CO32- |
可逆反应2SO2 (g)+ O2 (g)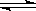 2SO3(g)达到平衡的标志是
2SO3(g)达到平衡的标志是
① 消耗2 mol SO2的同时生成2 mol SO3
②SO2、O2与SO3的物质的量之比为2∶1∶2
③ 反应混合物中,SO3的质量分数不再改变
| A.①② | B.①③ | C.只有③ | D.只有① |