在氧化铁和盐酸混和溶液中加入铁粉,待反应结束,所剩余的固体滤出后能被磁铁吸引,则反应后溶液中存在较多的阳离子是
| A.H+ | B.Fe2+ | C.Fe3+ | D.Cl- |
检验某固体样品中是否含NH4+的方法是,先取少量固体于试管中,然后
| A.加热,用湿润红色石蕊试纸在试管口检验 |
| B.加水溶解,用红色石蕊试纸检测溶液酸碱性 |
| C.加入弱碱溶液,加热,滴入酚酞试剂 |
| D.加入烧碱溶液,加热,用湿润石蕊试纸在试管中检验 |
将等体积的NO2和N2的混合气体置于试管中,并将试管倒立于水槽中,充分反应后,剩余气体的体积约为原总体积的
| A.1/6 | B.1/3 | C.2/3 | D.1/2 |
二氧化硅是酸性氧化物是因为
| A.硅是非金属 |
| B.它的对应水化物是弱酸,能溶于水 |
| C.它是非金属氧化物 |
| D.二氧化硅能跟氢氧化钠反应生成盐和水 |
用一充满氨气的烧瓶做喷泉实验,当水充满整个烧瓶后,烧瓶内的氨水的物质的量浓度是(按标准状况下计算)
| A.0.045mol·L-1 | B.1mol·L-1 |
| C.0.029mol·L-1 | D.不能确定 |
下列说法正确的是
| A.硅材料广泛用于光纤通讯 |
| B.工艺师利用盐酸刻蚀石英制作艺术品 |
| C.水晶项链和餐桌上的瓷盘都是硅酸盐制品 |
| D.粗硅制备单晶硅不涉及氧化还原反应 |
已知还原性Cl-<Fe2+<H2O2<I-<SO2,判断下列反应不能发生的是
| A.2Fe3++SO2+2H2O==SO42-+4H++2Fe2+ |
| B.I2+SO2+2H2O==H2SO4+2HI |
| C.H2O2+2H++SO42-==SO2+O2+2H2O |
| D.2Fe3++2I-==2Fe2++I2 |
下列物质不属于“城市空气质量日报”报道的是
| A.二氧化硫 | B.氮氧化物 | C.二氧化碳 | D.悬浮颗粒 |
某化学小组在常温下测定一定质量的某铜铝混合物中铜的质量分数,设计了如下实验方案:
方案Ⅰ:
方案Ⅱ:
下列有关判断中不正确的是
| A.溶液A和B均可以是盐酸或NaOH溶液 |
| B.溶液A和B均可以选用稀硝酸 |
| C.若溶液B选用浓硝酸,则测得铜的质量分数偏小 |
| D.实验室方案II更便于实施 |
某化学科研小组研究在其他条件不变时,改变某一条件对A2(g)+3B2(g) 2AB3(g)化学平衡状态的影响,得到如图所示的变化规律(图中T表示温度,n表示物质的量),根据图示可得出的判断结论正确的是
2AB3(g)化学平衡状态的影响,得到如图所示的变化规律(图中T表示温度,n表示物质的量),根据图示可得出的判断结论正确的是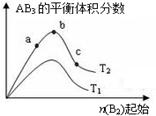
| A.达到平衡时,AB3的物质的量大小为:c>b>a |
| B.达到平衡时,A2的转化率大小为:b>a>c |
| C.若T2>T1,则正反应一定是放热反应 |
| D.a点的化学平衡常数小于c点的化学平衡常数 |
在甲、乙两烧杯溶液中,分别含有大量的 、
、 、
、 、
、 、
、 、
、 6种离子中的3种,已知乙烧杯的溶液呈黄色,则甲烧杯的溶液中大量存在的离子是
6种离子中的3种,已知乙烧杯的溶液呈黄色,则甲烧杯的溶液中大量存在的离子是
A. 、 、 、 、 |
B. 、 、 -、 -、 |
C. 、 、 、 、 |
D. 、 、 、 、 |
常温下,下列各溶液中微粒的物质的量浓度关系正确的是
| A.某物质的溶液pH < 7,则该物质一定是酸或强酸弱碱盐 |
| B.AgCl在同浓度的CaCl2和NaCl溶液中的溶解度相同 |
| C.pH=4的CH3COOH与CH3COONa混合溶液中,c(Na+) < c(CH3COO-) |
| D.将pH=6的H2SO4稀释1000倍后,c(H+)="2" c(SO42-) |