下列有关金属腐蚀与防护的说法正确的是
| A.银器表面在空气中因电化腐蚀渐渐变暗 |
| B.当镀锡铁制品的镀层破损时,镀层仍能对铁制品起保护作用 |
| C.在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法 |
| D.可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀 |
下列说法正确的是
| A.精炼铜时粗铜做阴极,纯铜做阳极 |
| B.电解MgCl2饱和溶液,可制得金属镁 |
| C.钢铁的腐蚀通常为电化学腐蚀,该腐蚀过程中负极反应为:Fe–3e-===Fe 3+ |
| D.氯碱工业和金属钠的冶炼都用到了NaCl,阳极反应都是:2C1一–2e-===C12↑ |
化学与人类生活密切相关。下列说法正确的是
| A.“钡餐”中使用的硫酸钡是弱电解质 |
| B.镀锌铁镀层破损后,铁更容易被腐蚀 |
| C.提倡人们购物时不用塑料袋,是为了防止白色污染 |
| D.推广使用太阳能、风能、海洋能、氢能,不利于缓解温室效应 |
家用炒菜铁锅用水清洗放置后,出现红棕色的锈斑,在此变化过程中不发生的化学反应是
| A.4Fe(OH)2+2H2O+O2=4Fe(OH)3 | B.2Fe+2H2O+O2=2Fe(OH)2 |
| C.2H2O+O2+4e-=4OH- | D.Fe-3e-=Fe3+ |
I.下列说法不正确的是 (填字母代码)。
A.对于Al(OH)3(s) Al(OH)3(aq) Al(OH)3(aq) Al3++3OH-,前者为溶解平衡,后者为电离平衡 Al3++3OH-,前者为溶解平衡,后者为电离平衡 |
| B.物质的溶解度随温度的升高而增加,故物质的溶解都是吸热的 |
| C.能源、信息与材料通常被称为现代社会发展的三大支柱 |
| D.镀层破损后,白铁(镀锌的铁)比马口铁(镀锡的铁)更易被腐蚀 |
E.除去硬水中的Mg2+,用OH-沉淀Mg2+比用CO32-效果好,说明Mg(OH)2溶解度比 MgCO3的小
II.向含有AgI的饱和溶液中:
(1)加入固体AgNO3,则c(I-) (填“变大”、“变小”或“不变”,下同)。
(2)若改加更多的AgI,则c(Ag+) 。
(3)若改加AgCl固体,则c(I-) ,而c(Ag+) 。
III.用“>”、“<”或“=”填空:
(1)25℃时1mol/L FeCl3溶液的pH 80℃时1mol/L FeCl3溶液的pH。
(2)已知NaHSO3溶液中c(HSO3-)>c(SO32-)>c(H2SO3),则溶液中c(H+) c(OH-)。
(3)常温下,取等物质的量浓度的HA溶液与NaOH溶液等体积混合,测得混合溶液的pH=8,混合溶液中由水电离出的c(H+)水 NaOH溶液中由水电离出的c(H+)水。
在钢铁的吸氧腐蚀中,发生还原反应的电极上的进行的电极反应是
| A.4 OH- -4e-=2H2O+O2↑ | B.2H++2e-=H2↑ |
| C.2H2O+O2+4e-="4" OH- | D.Fe-2e-= Fe2+ |
下列说法正确的是
| A.铅蓄电池放电时的负极和充电时的阳极均发生还原反应 |
| B.镀铜铁制品镀层受损后,铁制品比受损前更容易生锈 |
C.N2(g)+3H2(g) 2NH3(g) △H<0,其他条件不变时升高温度,反应速率v(H2)和氢气的平衡转化率均增大 2NH3(g) △H<0,其他条件不变时升高温度,反应速率v(H2)和氢气的平衡转化率均增大 |
| D.纯碱溶于热水中去污效果增强,说明纯碱的水解是放热反应 |
下列说法正确的是
| A.放热反应的反应速率一定大于吸热反应的反应速率 |
| B.熔融状态下能导电的化合物一定含离子键 |
| C.增大反应物浓度可加快反应速率,因此可用浓硫酸与铁反应增大生成氢气的速率 |
| D.在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阴极的阳极保护法 |
下列有关说法正确的是
| A.2NO(g)+2CO(g)=N2(g)+2CO2(g)在常温下能自发进行,则该反应的△H>0 |
| B.将钢闸门与直流电源的正极相连,可防止钢闸门腐蚀 |
C.恒温下,体积可变的密闭容器中发生反应2NO2 N2O4,向平衡体系中充入氩气,达到新平衡时,NO2的百分含量增大 N2O4,向平衡体系中充入氩气,达到新平衡时,NO2的百分含量增大 |
D.25℃时,将NH3•H2O稀溶液加水稀释, 的值不变 的值不变 |
下图是自来水表的常见安装方式。下列有关说法不正确的是
| A.该安装方式的水表更容易被腐蚀 |
| B.发生腐蚀过程中,电子从接头流向水表 |
| C.腐蚀时水表发生的电极反应为:2H2O+O2+4e—=4OH— |
| D.腐蚀过程还涉及到反应:4Fe(OH)2+2H2O+O2=4Fe(OH)3 |
(1)某兴趣小组利用如图所示装置进行实验。
闭合K1,U形管内除电极上有气泡外,还可观察到的现象是 ;在A注射器收集到的气体是 ,阳极电极反应式为 。当电路中转移0.001mol电子时,B注射器最多可以收集到气体 mL(折算为标准状况)。
(2)某兴趣小组利用如图所示装置进行实验,对钢铁的电化学腐蚀原理进行探究。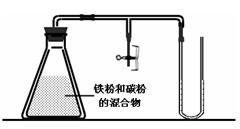
①首先向锥形瓶内加入铁粉和碳粉的混合物、氯化钠溶液,半分钟后发现U型管内左侧液面高过右侧液面,这现象说明,在中性条件下发生 腐蚀,请写出该反应的电极反应方程式
负极: 正极:
②清洗锥形瓶后,重新加入铁粉和碳粉的混合物,加入1mol/L醋酸溶液,半分钟后发现U型管内左侧液面高过右侧液面,这一现象说明,前半分钟 腐蚀占优势,请写出这时正极主要的电极反应方程式 ,5分钟后发现U型管内右侧液面高过左侧液面,此时 腐蚀占据优势,请写出此时正极的电极反应方程式 。
下列装置或操作能达到目的的是
| A.装置①探究H2SO4浓度对反应速率的影响 |
| B.装置②可用于测定中和热 |
| C.装置③探究Mg(OH)2能否转化成Fe(OH)3 |
| D.装置④可保护铁闸门不被腐蚀 |
铁及其化合物与生产、生活关系密切。
(1)下图是实验室研究海水对铁闸不同部位腐蚀情况的剖面示意图。
①该电化腐蚀称为 。
②图中A、B、C、D四个区域,生成铁锈最多的是 (填字母)。
(2)用废铁皮制取铁红(Fe2O3)的部分流程示意图如下:
①步骤I若温度过高,将导致硝酸分解。硝酸分解的化学方程式为 。
②步骤II中发生反应:4Fe(NO3) 2+O2+(2n+4)H2O=2Fe2O3·nH2O+8HNO3,反应产生的HNO3又将废铁皮中的铁转化为Fe(NO3)2,该反应的化学方程式为 。
③上述生产流程中,能体现“绿色化学”思想的是 (任写一项)。
(3)已知t℃时,反应FeO(s)+CO(g) Fe(s)+CO2(g)的平衡常数K=0.25。
Fe(s)+CO2(g)的平衡常数K=0.25。
①t℃时,反应达到平衡时n(CO):n(CO2)= 。
②若在1 L密闭容器中加入0.02 mol FeO(s),并通入x molCO,t℃时反应达到平衡。此时FeO(s)转化率为50%,则x= 。
铁制自来水管与下列材料做成的水龙头连接,锈蚀最快的铁水管所连接的是
| A.塑料水龙头 | B.铁水龙头 | C.铜水龙头 | D.陶瓷水龙头 |
有关金属的腐蚀与防护的叙述正确的是
| A.金属的化学腐蚀比电化学发生普遍 |
| B.上图装置的原理是“牺牲阳极的阴极保护法” |
| C.金属腐蚀的本质是M-ne-→Mn+而被损耗 |
| D.用铝制铆钉来接铁板,铁板易被腐蚀 |