广东省广雅等四校高二上学期期末联考化学试卷
常温下,下列变化过程不是自发的是
| A.原电池产生电流 | B.石灰石的分解 |
| C.在密闭条件下体系从有序变为无序 | D.Ba(OH)2·8H2O与NH4Cl的反应 |
下列各组关于强电解质、弱电解质、非电解质的归类,完全正确的是
| 选项 |
强电解质 |
弱电解质 |
非电解质 |
| A |
CaCO3 |
H2SiO3 |
酒精 |
| B |
NaCl |
NH3 |
BaSO4 |
| C |
Fe |
CH3COOH |
蔗糖 |
| D |
HNO3 |
Fe(OH)3 |
H2O |
下列溶液一定呈中性的是
| A.pH = 7的溶液 |
| B.Kw = c(H+)·c(OH-) = 1.0×10-14的溶液 |
| C.c(H+) = c(OH-) |
| D.pH = 3的酸与pH = 11的碱等体积混合后的溶液 |
下列过程或现象与盐类水解无关的是
| A.将FeCl3溶于盐酸配制FeCl3溶液 |
| B.加热稀醋酸溶液其pH降低 |
| C.用低浓度铁盐溶液获得纳米氧化铁 |
| D.小苏打溶液与AlCl3溶液混合产生气体和沉淀 |
某学生的实验报告所列出的下列数据中合理的是
| A.用10 mL量筒量取7.13 mL稀盐酸 |
| B.用托盘天平称量25.20 g NaCl |
| C.用广泛pH试纸测得某溶液的pH为2.3 |
| D.用25 mL滴定管做中和滴定实验时,用去某浓度的碱溶液21.70 mL |
一种一元强酸HA溶液中加入一种碱MOH,溶液呈中性,下列判断一定正确的是
| A.加入的碱过量 |
| B.生成的盐发生水解 |
| C.反应后溶液中c(A-) = c(M+) |
| D.混合前酸与碱中溶质的物质的量相等 |
用铁片与稀硫酸反应制取氢气时,下列措施不能使氢气生成速率加大的是
| A.加热 | B.不用稀硫酸,改用98%浓硫酸 |
| C.滴加少量CuSO4溶液 | D.不用铁片,改用铁粉 |
25℃时,水的电离达到平衡:H2O H+ + OH-,下列叙述正确的是
H+ + OH-,下列叙述正确的是
| A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低 |
| B.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变 |
| C.向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低 |
| D.将水加热,Kw增大,pH不变 |
下列说法正确的是
| A.草酸溶液与酸性KMnO4溶液混合后,由于生成物对反应有催化作用,会使反应速率加快 |
| B.KI、H2SO4、淀粉溶液混合后,高温时出现蓝色时间反而较短,可能是因为高温时此反应较慢 |
| C.恒温下,将盛有NO2和N2O4的平衡体系加压,体系颜色最终变浅 |
| D.在K2Cr2O7溶液中滴加浓硫酸,溶液颜色由橙变黄(Cr2O72-为橙色) |
下列各组离子中,在给定条件下能大量共存的是
| A.在pH = 1的溶液中:NH4+、K+、ClO-、Cl- |
| B.有SiO32-存在的溶液中:Na+、Mg2+、Al3+、Cl- |
| C.有NO3-存在的强酸性溶液中:NH4+、Ba2+、Fe2+ 、Br- |
| D.在c(H+) = 1.0×10-13 mol·L-1的溶液中:Na+、S2-、AlO2-、SO32- |
臭氧是理想的烟气脱硝试剂,其脱硝反应为2NO2(g) + O3(g) N2O5(g) + O2(g),若反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是
N2O5(g) + O2(g),若反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是
| A |
B |
C |
D |
 |
 |
 |
 |
| 升高温度, 平衡常数减小 |
0~3 s内,反应速率为 v(NO2) =" 0.2" mol·L-1 |
t1时仅加入催化剂,平衡正向移动 |
达平衡时,仅改变x,则x为c(O2) |
强酸溶液A与强碱溶液B,在常温下其pH之和为15,当它们按一定体积比混合时,溶液的pH恰好为7,则A与B的体积比为
| A.1∶1 | B.2∶1 | C.1∶10 | D.10∶1 |
某同学组装了如图所示的电化学装置,电极Ⅰ为 Zn,电极Ⅱ为Cu,其他电极均为石墨,则下列说法正确的是

|
A.电流方向:电极Ⅳ →○→电极Ⅰ
B.盐桥中的K+会移向ZnSO4溶液C.处得到标况下气体2.24L,电极II上析出6.4g固体
D.NaCl溶液中,电极Ⅲ制得氯气,电极Ⅳ制得金属钠
下列叙述正确的是
| A.KSp[MgF2]>KSp[Mg(OH)2],不能实现Mg(OH)2转化为MgF2。 |
| B.常温下,同浓度的Na2S与NaHS溶液相比,Na2S溶液的pH大 |
| C.等物质的量浓度的NH4Cl溶液和NH4HSO4溶液,后者的c(NH4+)大 |
| D.FeCl3与KSCN反应达到平衡时,加入KCl溶液,则溶液颜色变深 |
下列各溶液中,微粒的物质的量浓度关系正确的是
| A.0.1 mol/L Na2CO3溶液:c(OH-) = c(HCO3-) + c(H+) + 2c(H2CO3) |
| B.0.1 mol/L NH4Cl溶液:c(NH4+) = c(Cl-) |
| C.向醋酸钠溶液中加适量醋酸,得到的酸性混合溶液:c(Na+) > c(CH3COO-) > c(H+) > c(OH-) |
| D.向硝酸钠溶液中滴加稀盐酸得到pH = 5的混合溶液:c(Na+) = c(NO3-) |
下列装置或操作能达到目的的是
| A.装置①探究H2SO4浓度对反应速率的影响 |
| B.装置②可用于测定中和热 |
| C.装置③探究Mg(OH)2能否转化成Fe(OH)3 |
| D.装置④可保护铁闸门不被腐蚀 |
T℃时,向2.0 L恒容密闭容器中充入1.0 mol COCl2,反应COCl2(g) Cl2(g) + CO(g),经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
Cl2(g) + CO(g),经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
| t / s |
0 |
2 |
4 |
6 |
8 |
| n(Cl2) / mol |
0 |
0.16 |
0.19 |
0. 20 |
0.20 |
下列说法正确的是
A.反应在前2 s 的平均速率v(CO) =" 0.080" mol·L-1·s-1
B.保持其他条件不变,升高温度,平衡时c(Cl2) =" 0.11" mol·L-1,则反应的ΔH < 0
C.T℃时起始向容器中充入0.9 mol COCl2、0.20 mol Cl2和0.20 mol CO,达平衡前v正 > v逆
D.恒温恒容下,平衡后向体系内加入少量惰性气体,氯气的浓度不变
(1)氨的合成是最重要的化工生产之一,工业上合成氨用的H2有多种制取的方法。用天然气跟水蒸气反应:CH4(g)+H2O(g)  CO(g)+3H2(g)。已知有关反应的能量变化如下图所示,则此制取H2反应的ΔH=____________。
CO(g)+3H2(g)。已知有关反应的能量变化如下图所示,则此制取H2反应的ΔH=____________。
(2)已知通常状况下,每充分燃烧1gCO并恢复到原状态,会释放10KJ的热量。请写出表示CO燃烧热的热化学反应方程式: 。
(3)一种甲烷燃料电池是采用铂或碳化钨作为电极催化剂,在稀硫酸电解液中直接通入甲烷,同时向一个电极通入空气。此电池的负极电极反应式是________________________________________________。
(4)利用下图装置可以模拟铁的电化学防护。
①若X为碳棒,为减缓铁的腐蚀,开关K应置于 处。假设海水中只有NaCl溶质,写出此时总离子反应方程式: 。
②若X为锌,开关K置于M处,该电化学防护法称为 。
写出铁电极处的电极反应式: 。
将0.8 mol I2(g)和1.2 mol H2(g)置于某1L密闭容器中,在一定温度下发生反应:I2(g)+H2(g)  2HI(g)并达到平衡。HI的体积分数随时间的变化如表格所示:
2HI(g)并达到平衡。HI的体积分数随时间的变化如表格所示:
| HI体积分数 |
1min |
2min |
3min |
4min |
5min |
6min |
7min |
| 条件I |
26% |
42% |
52% |
57% |
60% |
60% |
60% |
| 条件II |
20% |
33% |
43% |
52% |
57% |
65% |
65% |
(1)在条件I到达平衡时,计算该反应的平衡常数K,要求列出计算过程。
(2)在条件I从开始反应到到达平衡时,H2的反应速率为____________。
(3)为达到条件II的数据,对于反应体系可能改变的操作是_______________。
(4)该反应的△H_____0(填">","<"或"=")
(5)在条件I下达到平衡后,在7min时将容器体积压缩为原来的一半。请在图中画出c(HI)随时间变化的曲线。
(14分)某工业原料主要成分是NH4Cl、FeCl3和AlCl3。利用此原料可以得到多种工业产品。分析下面流程,回答问题。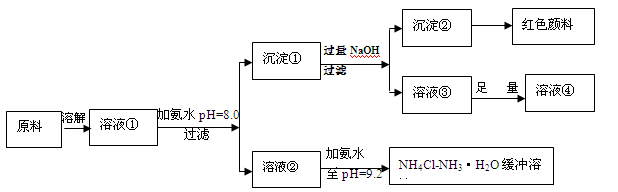
已知:Ksp[Fe(OH)3]=4.0×10-38
(1)用稀硫酸中和等体积等pH值的氨水和烧碱溶液,前者需要消耗的酸液体积 (填“大”“小”或“相同”)
(2)计算溶液②中Fe3+的物质的量浓度为 mol/L
(3)缓冲溶液中存在的平衡体系有: 、 、
此时溶液中c(NH4+) c(Cl-)(填>、=、<)。
(4)在缓冲溶液中加入少量盐酸或者NaOH溶液,溶液的pH值几乎依然为9.2。简述原理:
请举出另一种缓冲溶液的例子(写化学式) 。
(5)常温下向较浓的溶液④中不断通入HCl气体,可析出大量AlCl3·6H2O晶体,结合化学平衡移动原理解释析出晶体的原因: 。
某酸性工业废水中含有K2Cr2O7。光照下,草酸(H2C2O4)能将其中的Cr2O72-转化为Cr3+。某课题组研究发现,少量铁明矾[Al2Fe(SO4)4 ·4H2O]即可对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下:
(1)在25°C下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始pH和一定浓度草酸溶液用量,作对比实验,完成以下实验设计表(表中不要留空格)。
| 实验编号 |
初始pH |
废水样品体积/mL |
草酸溶液体积/mL |
蒸馏水体积/mL |
| ① |
4 |
B= |
10 |
30 |
| ② |
5 |
60 |
10 |
d= |
| ③ |
a= |
60 |
c= |
20 |
测得实验①和②溶液中的Cr2O72-浓度随时间变化关系如图所示。
(2)上述反应后草酸被氧化为 (填化学式);
(3)实验①和②的结果表明_______________________________;
(4)该课题组对铁明矾[Al2Fe(SO4)4 ·4H2O]中起催化作用的成分提出如下假设,请你完成假设二和假设三:
假设一:Fe2+起催化作用;假设二: ;假设三: ;……
(5)请你设计实验验证上述假设一,完成下表中内容。(除了上述实验提供的试剂外,可供选择的药品有K2SO4、FeSO4、K2SO4·Al2(SO4)3·24H2O、Al2(SO4)3等。(溶液中Cr2O72-的浓度可用仪器测定)
| 实验方案(不要求写具体操作过程) |
预期实验结果和结论 |
| 取_______________________________代替实验①中的铁明矾,控制其他反应条件与实验①相同,进行对比实验 |
反应进行相同时间后, 若溶液中的Cr2O72-浓度____________________________则假设一成立; 若溶液中的Cr2O72-浓度____________________________则假设一不成立; |
(6)铁明矾长期存放,其中的亚铁离子可能会变质。为测定铁明矾中亚铁离子的质量分数。取5.6g铁明矾晶体,将其配制为100ml的溶液,取出20ml置于锥形瓶中。用0.01mol/L的标准KMnO4溶液进行滴定(还原产物为Mn2+),平行做4组实验,得出如下表数值。
| 组数 |
1 |
2 |
3 |
4 |
| 消耗V(KMnO4)/ml |
20.04 |
20.00 |
18.90 |
19.96 |
请计算铁明矾中亚铁离子的质量分数: 。若滴定结束后读数时仰视,测定结果 (填“偏大”“不影响”或“偏小”)
 粤公网安备 44130202000953号
粤公网安备 44130202000953号