把下列四种X的溶液,分别加进四个盛有10毫升,2摩/升的盐酸的烧杯中,并均加水稀释至50毫升,此时X和盐酸缓和地进行反应,其中反应速度最大的是
| A.10毫升、2摩/升 |
| B.20毫升、2摩/升 |
| C.10毫升、4摩/升 |
| D.20毫升、3摩/升 |
反应N2+3H2 2NH3在2L的密闭器中进行,半分钟内有0.6mol的NH3生成,下列反应速率不正确的</PGN0025A.TXT/PGN>是
2NH3在2L的密闭器中进行,半分钟内有0.6mol的NH3生成,下列反应速率不正确的</PGN0025A.TXT/PGN>是

把一块锌放在100mL pH值为1的盐酸中,经2min后pH值变为2,则H2产生速度是
| A.0.5 mol/(L·min) |
| B.0.0225 mol/(L·min) |
| C.0.0045mol/(L·min) |
| D.0.00225mol/(L·min) |
在密闭容器中,合成氨反应N2+3H2 2NH3,开始时c(N2)="8" mol ·L-1,c(H2)="20" mol ·L-1,5 min后c′(N2)="6" mol ·L-1。求v(N2)、v(NH3)、v(H2)。
2NH3,开始时c(N2)="8" mol ·L-1,c(H2)="20" mol ·L-1,5 min后c′(N2)="6" mol ·L-1。求v(N2)、v(NH3)、v(H2)。
将Zn投入一定浓度一定体积的盐酸中,H2的生成速率与时间的关系如图所示,试解释图中曲线变化的原因(纵坐标为H2的生成速率,横坐标为时间)。
答:① ;
② 。
下列措施不能够使化学反应速率加快的是
| A.升高温度 | B.降低温度 | C.使用催化剂 | D.增大固体反应物面积 |
将等物质的量的H2和I2(g)加入密闭容器中进行反应:H2+I2(g) 2HI,反应进行到2min时测得反应速率υ(HI)=0.1mol/(L·min),I2(g)的物质的量浓度为0.4mol/L。
2HI,反应进行到2min时测得反应速率υ(HI)=0.1mol/(L·min),I2(g)的物质的量浓度为0.4mol/L。
(1)反应速率υ(H2)= ,υ(I2)= 。
(2)2min未[HI]= mol/L。
(3)起始时,[H2]= mol/L,[I2]= mol/L。
在N2+3H2 2NH3的反应中,经一段时间后,NH3的物质的量浓度增加了0.6mol/L,在此时间内,用H2物质的量浓度表示的平均速率为0.45mol/(L·s),则反应所经过的时间为( )
2NH3的反应中,经一段时间后,NH3的物质的量浓度增加了0.6mol/L,在此时间内,用H2物质的量浓度表示的平均速率为0.45mol/(L·s),则反应所经过的时间为( )
| A.0.5s | B.1.0s | C.1.5s | D.2.0s |
在一个容积为2L的密闭容器中,发生如下反应:3A(g)+2B(g)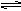 2C(g),若最初加入的A、B都是4mol,A的平均反应速率为0.12mol/(L·s),则10s后容器中的B是( )
2C(g),若最初加入的A、B都是4mol,A的平均反应速率为0.12mol/(L·s),则10s后容器中的B是( )
A.2.8mol B.1.6mol C.2.4mol D.3.6mol
对于A2+3B2 2AB3这一可逆反应,在一定时间内,以下为在不同条件下的反应速率,其中速率最大的是( )
2AB3这一可逆反应,在一定时间内,以下为在不同条件下的反应速率,其中速率最大的是( )
| A.υ(A2)=0.4mol/(L·min) | B.υ(B2)=0.8mol/(L·min) |
| C.υ(AB3)=0.6mol/(L·min) | D.υ(A2)=0.01mol/(L·s) |
智利硝石矿层中含有碘酸钠,可用亚硫酸氢钠与其反应来制备单质碘。
(1)试配平该反应的化学方程式,并用短线标出电子转移方向及总数。
(2) 
(2)已知含氧酸盐的氧化作用随溶液酸性的加强而增强,在制备实验时,定时取样,并用酸化的氯化钡来检测SO 生成的量,发现开始阶段反应速率呈递增的趋势,试简述这一变化趋势发生的原因: 。
生成的量,发现开始阶段反应速率呈递增的趋势,试简述这一变化趋势发生的原因: 。
反应4NH3+5O2 4NO+6H2O在5 L密闭容器中进行,半分钟后,NO的物质的量增加了0.3 mol,则此反应的平均速率
4NO+6H2O在5 L密闭容器中进行,半分钟后,NO的物质的量增加了0.3 mol,则此反应的平均速率 (X)(表示反应物的消耗速率或生成物的生成速率)为
(X)(表示反应物的消耗速率或生成物的生成速率)为
A. (O2)=0.01 mol·L-1·s-1 (O2)=0.01 mol·L-1·s-1 |
B. (NO)=0.008 mol·L-1·s-1 (NO)=0.008 mol·L-1·s-1 |
C. (H2O)=0.003 mol·L-1·s-1 (H2O)=0.003 mol·L-1·s-1 |
D. (NH3)=0.002 mol·L-1·s-1 (NH3)=0.002 mol·L-1·s-1 |
反应速率v和反应物浓度的关系是用实验方法测定的,化学反应H2+Cl2===2HCl的反应速率v可表示为v=k[c(H2)]m[c(Cl2)]n,式中k为常数,m、n值可用下表中数据确定之。
由此可推得,m、n值正确的是
| A.m=1,n="1" | B.m= ,n= ,n= |
C.m= ,n="1" ,n="1" |
D.m=1,n= |
某化学反应2A===B+D在四种不同条件下进行。B、D起始浓度为0。反应物A的浓度(mol·L-1)随反应时间(min)的变化情况如下表:
根据上述数据,完成下列填空:

(1)在实验1,反应在10至20分钟时间内平均速率为 mol·(L·min)-1。
(2)在实验2,A的初始浓度c2=__________mol·L-1,反应经20分钟就达到平衡,可推测实验2中还隐含的条件是__________。
(3)设实验3的反应速率为v3,实验1的反应速率为v1,则v3__________v1(填“>”“=”或“<”=,且c3__________1.0 mol·L-1(填“<”“=”或“>”)。
(4)比较实验4和实验1,可推测该反应是__________反应(填“吸热”或“放热”)。理由是 。