将等物质的量的H2和I2(g)加入密闭容器中进行反应:H2+I2(g)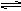 2HI,反应进行到2min时测得反应速率υ(HI)=0.1mol/(L·min),I2(g)的物质的量浓度为0.4mol/L。
2HI,反应进行到2min时测得反应速率υ(HI)=0.1mol/(L·min),I2(g)的物质的量浓度为0.4mol/L。
(1)反应速率υ(H2)= ,υ(I2)= 。
(2)2min未[HI]= mol/L。
(3)起始时,[H2]= mol/L,[I2]= mol/L。
将等物质的量的H2和I2(g)加入密闭容器中进行反应:H2+I2(g)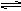 2HI,反应进行到2min时测得反应速率υ(HI)=0.1mol/(L·min),I2(g)的物质的量浓度为0.4mol/L。
2HI,反应进行到2min时测得反应速率υ(HI)=0.1mol/(L·min),I2(g)的物质的量浓度为0.4mol/L。
(1)反应速率υ(H2)= ,υ(I2)= 。
(2)2min未[HI]= mol/L。
(3)起始时,[H2]= mol/L,[I2]= mol/L。