智利硝石矿层中含有碘酸钠,可用亚硫酸氢钠与其反应来制备单质碘。
(1)试配平该反应的化学方程式,并用短线标出电子转移方向及总数。
(2) 
(2)已知含氧酸盐的氧化作用随溶液酸性的加强而增强,在制备实验时,定时取样,并用酸化的氯化钡来检测SO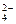 生成的量,发现开始阶段反应速率呈递增的趋势,试简述这一变化趋势发生的原因: 。
生成的量,发现开始阶段反应速率呈递增的趋势,试简述这一变化趋势发生的原因: 。
智利硝石矿层中含有碘酸钠,可用亚硫酸氢钠与其反应来制备单质碘。
(1)试配平该反应的化学方程式,并用短线标出电子转移方向及总数。
(2) 
(2)已知含氧酸盐的氧化作用随溶液酸性的加强而增强,在制备实验时,定时取样,并用酸化的氯化钡来检测SO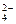 生成的量,发现开始阶段反应速率呈递增的趋势,试简述这一变化趋势发生的原因: 。
生成的量,发现开始阶段反应速率呈递增的趋势,试简述这一变化趋势发生的原因: 。