在某温度时,在2L容器中X、Y、Z三种气体物质的量随时间的变化关系曲线如图所示。
(1)由图中的数据分析,该反应的化学方程式为_____________。在该温度下,此化学反应的平衡常数表达式为_______________。
(2)反应开始至5min,Y的转化率为____________。
(3)在其他条件不变的情况下,如果起始充入X、Y、Z的物质的量分别为4mol、6mol、2mol,则此反应向___________(填“正反应”,“逆反应”)方向进行。
可逆反应2A(g)+B(g) 2C(g),根据下表中的数据判断下列图象错误的是( )
2C(g),根据下表中的数据判断下列图象错误的是( )


在一个容积为6L的密闭容器中,放入3LX(g)和2LY(g),在一定条件下发生反应:4X(g)+nY(g) 2Q(g)+6R(g)达到平衡后,容器内温度不变,混合气体的压强比原来增加5%,X的浓度减小1/3,则该反应中的n值是
2Q(g)+6R(g)达到平衡后,容器内温度不变,混合气体的压强比原来增加5%,X的浓度减小1/3,则该反应中的n值是
| A.3 | B.4 | C.5 | D.6 |
在恒容的密闭容器中,进行化学反应CO2 (g)+H2 (g) CO (g)+H2O (g),其化学平衡常数K和温度t的关系如下表:
CO (g)+H2O (g),其化学平衡常数K和温度t的关系如下表:
| t / ℃ |
700 |
800 |
830 |
1000 |
1200 |
| K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=____________。
(2)正反应为________反应(填“吸热”或“放热”)。
(3)能判断该反应是否达到化学平衡状态的依据是________(多选无分)。
A.容器中压强不变 B.混合气体中c (CO)不变
C.v正(H2)=v逆(H2O) D.c (CO2)="c" (CO)
(4)某温度下,平衡浓度符合下式:c (CO2)·c (H2)="c" (CO)·c (H2O)。可判断此时的温度为________℃。
| 实验 编号 |
HX物质的量 浓度(mol/L) |
NaOH物质的 量浓度(mol/L) |
混合溶液的pH |
| 甲 |
0.2 |
0.2 |
pH=a |
| 乙 |
c1 |
0.2 |
pH=7 |
| 丙 |
0.2 |
0.1 |
pH>7 |
| 丁 |
c2 |
c2 |
pH=10 |
下列事实中,不能用勒夏特列原理解释的是( )
| A.向稀盐酸中加入少量蒸馏水,盐酸中氢离子浓度降低 |
| B.实验室中常用排饱和食盐水的方式收集氯气 |
| C.打开汽水瓶,有气泡从溶液中冒出 |
| D.对熟石灰的悬浊液加热,悬浊液中固体质量增加 |
NO和CO都是汽车尾气中的有害物质,它们能缓慢地起反应,反应的化学方程式为:
2CO+2NO=N2+2CO2,为了控制大气污染,下列措施切实可行的是( )
| A.改变压强 | B.提高温度 |
| C.使用催化剂 | D.用耐高压储气罐收集尾气,集中处理 |
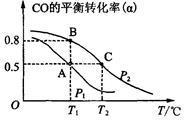
升高温度,下列数据不一定增大的是
A.化学反应速率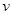 |
B.弱酸的电离平衡常数Ka |
| C.化学平衡常数K | D.水的离子积常数KW |
可逆反应在一定条件下达到化学反应限度时,下列说法正确的是
| A.反应停止了 |
| B.正反应速率与逆反应速率均为零 |
| C.反应物和生成物浓度相等 |
| D.正反应速率和逆反应速率相等 |
将0.5 mol SO2和0.2 mol O2置于密闭容器中发生反应:2SO2+O2 2SO3。下列关于该反应的说法正确的是
2SO3。下列关于该反应的说法正确的是
| A.最终可生成0.4 mol SO3 | B.当v正(O2)= v逆(SO2) = 0时一定达化学平衡 |
| C.升高温度反应速率减小 | D.缩小体积增大压强反应速率增大 |
空气质量与我们的健康息息相关,目前我国通过监测6项污染物的质量浓度来计算空气质量指数(AQI),SO2、NO2和CO是其中3项中的污染物。
(1)一定温度下,向固定体积为2 L的密闭容器中充入SO2和NO2各1 mol,发生反应SO2(g)+NO2(g)  SO3(g)+NO(g),测得上述反应5 min末到达平衡,此时容器中NO与NO2的体积比为3︰1,则这段时间内SO2的反应速率υ(SO2)= ,此反应在该温度下的平衡常数K= 。
SO3(g)+NO(g),测得上述反应5 min末到达平衡,此时容器中NO与NO2的体积比为3︰1,则这段时间内SO2的反应速率υ(SO2)= ,此反应在该温度下的平衡常数K= 。
(2)甲醇日趋成为重要的有机燃料,通常利用CO和H2合成甲醇,其反应的化学方程式为CO(g)+2H2(g)  CH3OH(g)。今在一容积可变的密闭容器中,充有10 mol CO和20 mol H2用于合成甲醇。CO的平衡转化率(α)与温度(T)、压强(P)的关系如图所示:
CH3OH(g)。今在一容积可变的密闭容器中,充有10 mol CO和20 mol H2用于合成甲醇。CO的平衡转化率(α)与温度(T)、压强(P)的关系如图所示:
①上述合成甲醇的反应为 反应(填“放热”或“吸热”)。
②A、B、C三点的平衡常数KA、KB、KC的大小关系为 。A、B两点对应的压强大小关系是PA PB(填“大于”、 “小于”或“等于”)。
③若将达到平衡状态A时生成的甲醇用于构成甲醇一氧气燃料电池,电解质溶液为KOH浓溶液,则该电池工作时正极的电极反应式为 ,理论上通过外电路的电子最多为 mol。
工业合成氨反应的能量变化如图所示。

(1)写出合成氨反应的热化学方程式:
(2)在甲乙两个体积均为2L固定容积的密闭容器中,分别充入甲:1molN2、3molH2和乙:1molN2、3molH2、1molHe,(其它条件相同),反应速率甲 乙(填大于、小于或等于),经过足够长的时间后在甲容器中该反应放出的热量(或吸收的热量) 92.4kJ(填“大于”、 “小于”或“等于”)
(3)下列图像分别代表焓变(△H )、混合气体平均相对分子质量(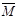 )、N2体积分数φ(N2)和气体密度(ρ)与反应时间关系,其中正确且能表明该可逆反应达到平衡状态的是 。
)、N2体积分数φ(N2)和气体密度(ρ)与反应时间关系,其中正确且能表明该可逆反应达到平衡状态的是 。

图像能直观地反映有关物理量的变化及规律,下列各图像与描述相符的是




图1 图2 图3 图4
| A.图1表示SO2氧化反应分别在有、无催化剂的情况下反应过程中的能量变化 |
| B.图2表示0.1 mol MgCl2·6H2O在空气中充分加热时固体质量随时间的变化 |
| C.图3表示分别稀释1 mL pH=2的盐酸和醋酸时溶液pH的变化,图中b>100mL |
D.图4表示平衡2NO2(g) N2O4(g)在t1时迅速将体积缩小后c(N2O4)的变化 N2O4(g)在t1时迅速将体积缩小后c(N2O4)的变化 |
在容积不变的密闭容器中,一定条件下发生反应:2A ⇌B(g)+2C(g),且达到平衡。当升高温度时气体的密度增大,则下列叙述中正确的是
| A.升高温度,正反应速率增大,逆反应速率减小 |
| B.若正反应是放热反应,则A为气态 |
| C.若向容器中充入惰性气体,则平衡向右移动 |
| D.物质A一定为非气态,且正反应是吸热反应 |
下列事实不能用勒夏特列原理解释的是
| A.用排饱和食盐水的方法收集氯气 |
| B.在沸腾的蒸馏水中滴加FeCl3溶液,制Fe(OH)3胶体 |
| C.在FeCl3溶液中加AgNO3溶液,产生白色沉淀 |
| D.向AgCl 和水的悬浊液中加入足量的Na2S溶液并振荡,白色固体转化为黑色固体 |
甲醇是重要的化工原料,在工业生产上的应用十分广泛。
(1)利用太阳能或生物质能分解水制H2,然后可将H2与CO2转化为甲醇。
已知:光催化制氢:2H2O(l)==2H2(g)+O2(g) ΔH=+571.5 kJ/mol
H2与CO2耦合反应:3H2(g)+CO2(g)==CH3OH(l)+H2O(l) ΔH=-137.8 kJ/mol
则反应:2H2O(l)+CO2(g) ="=" CH3OH(l)+3/2O2(g)的ΔH= kJ/mol
你认为该方法需要解决的技术问题有 。
a. 开发高效光催化剂
b. 将光催化制取的H2从反应体系中有效分离,并与CO2耦合催化转化
c. 二氧化碳及水资源的来源供应
(2)工业上由甲醇制取甲醛的两种方法如下(有关数据均为在298 K时测定):
反应I:CH3OH(g)=HCHO(g)+H2(g) ΔH1=+92.09kJ/mol,K1=3.92×10-11。
反应II:CH3OH(g)+1/2O2(g)=HCHO(g)+H2O(g) ΔH2=-149.73 kJ/mol,K2=4.35×1029。
①从原子利用率看,反应(填“I”或“II”。下同)制甲醛的原子利用率更高 。从反应的焓变和平衡常数K值看,反应 制甲醛更有利。(原子利用率表示目标产物的质量与生成物总质量之比。)
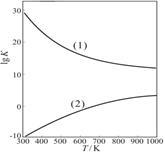
②右图是甲醇制甲醛有关反应的lgK(平衡常数的对数值)随温度T的变化。图中曲线(1)表示 (填“I”或“II”)的反应 。
(3)污水中的含氮化合物,通常先用生物膜脱氮工艺进行处理,在硝化细菌的作用下将NH4+氧化为
NO3-(2NH4++3O2=2HNO2+2H2O +2H+;2HNO2 +O2=2HNO3)。然后加入甲醇,甲醇和NO3-反应转化为两种无毒气体。
①上述方法中,1 g铵态氮元素转化为硝态氮元素时需氧的质量为 g。
②写出加入甲醇后反应的离子方程式:
(4)某溶液中发生反应:A 2B+C,A的反应速率v(A)与时间t的图象如图所示。若溶液的体积为2L,且起始时只加入A物质,下列说法错误的是
2B+C,A的反应速率v(A)与时间t的图象如图所示。若溶液的体积为2L,且起始时只加入A物质,下列说法错误的是

A.图中阴影部分的面积表示0~2min内A的物质的量浓度的减小值
B.反应开始的前2min,A的平均反应速率小于0.375mol・L-1・min-1
C.至2min时,A的物质的量减小值介于0.5mol至1mol之间
D.至2min时,B的物质的量浓度c(B)介于1~1.5mol・L-1之间