Ⅰ.合成氨工业对化学和国防工业具有重要意义。写出氨的两种重要用途_________________________________。
Ⅱ.实验室制备氨气,下列方法中适宜选用的是__________________。
①固态氯化铵加热分解
②固体氢氧化钠中滴加浓氨水
③氯化铵溶液与氢氧化钠溶液共热
④固态氯化铵与氧化钙混合加热
Ⅲ.为了在实验室利用工业原料制备少量氨气,有人设计了如下装置(图119中夹持装置均已略去)。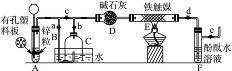
图1-9
[实验操作]
①检查实验装置的气密性后,关闭弹簧夹a、b、c、d、e。在A中加入锌粒,向长颈漏斗注入一定量稀硫酸。打开弹簧夹c、d、e,则A中有氢气产生。在F出口处收集氢气并检验其纯度。
②关闭弹簧夹c,取下截去底部的细口瓶C,打开弹簧夹a,将氢气经导管B验纯后点燃,然后立即罩上无底细口瓶C,塞紧瓶塞,如图所示。氢气继续在瓶内燃烧,几分钟后火焰熄灭。
③用酒精灯加热反应管E,继续通氢气,待无底细口瓶C内水位下降到液面保持不变时,打开弹簧夹b,无底细口瓶C内气体经D进入反应管E,片刻后F中的溶液变红。
完成下列问题:
(1)检验氢气纯度的目的是___________________________。
(2)C瓶内水位下降到液面保持不变时,A装置内发生的现象是__________________,防止了实验装置中压强过大。此时再打开弹簧夹b的原因是___________________________,C瓶内气体的成分是_________。
(3)在步骤③中,先加热铁触媒的原因是____________________________________。反应管E中发生反应的化学方程式是___________________________。
已知三角锥型分子E和直线型分子G反应,生成两种直线型分子L和M(组成E、G、L、M分子的元素原子序数均小于10)如图15,则下列判断错误的是( )

图1-5
| A.G是最活泼的非金属单质 |
| B.L是极性分子 |
| C.E能使紫色石蕊试液变蓝色 |
| D.M化学性质活泼 |
加入氢氧化钡溶液共热,有气体放出又有不溶于稀硝酸的白色沉淀生成的是( )
| A.KNO3溶液 |
| B.NH4NO3溶液 |
| C.(NH4)2SO4溶液 |
| D.Na2SO4溶液 |
对于1 mol·L-1的氨水,下列叙述正确的是(忽略溶液混合时的体积变化)( )
| A.将标准状况下22.4 L氨气溶于1 L水中配成溶液,即可得1 mol·L-1的氨水 |
| B.1 mol·L-1的氨水的质量分数小于1.7% |
| C.将1 mol·L-1的氨水与水等质量混合后,所得氨水的物质的量浓度大于0.5 mol·L-1 |
| D.将1 mol·L-1的氨水与3 mol·L-1的氨水等质量混合后,所得氨水的物质的量浓度为2 mol·L-1 |
氨水显弱碱性的主要原因是( )
| A.通常状况下,氨的溶解度不大 |
| B.氨水中的NH3·H2O电离出少量OH- |
| C.溶于水的氨分子只有少量电离 |
| D.氨本身的碱性弱 |
制取氨气并完成喷泉实验(图中夹持装置均已略去)。
(1)写出实验室制取氨气的化学方程式:_________________________________________。
(2)收集氨气应使用___________法,要得到干燥的氨气可选用_____________作干燥剂。
(3)用图A装置进行喷泉实验,上部烧瓶已装满氨气,引发水上喷的操作是___________。该实验的原理是___________________。
(4)如果只提供如图B的装置,请说明引发喷泉的方法:___________________________。
某混合气体可能有CO、CO2、NH3、HCl、H2和水蒸气中的一种或几种,当依次通过澄清石灰水(无浑浊现象)、氢氧化钡溶液(有浑浊现象)、浓硫酸、灼热的氧化铜(变红)和无水硫酸铜(变蓝)时,则可断定该混合气中一定有( )
| A.HCl、CO2、H2 | B.CO、H2、H2O |
| C.CO、H2、NH3 | D.HCl、CO、H2O |
在如下图所示装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶。则a和b分别是( )

| |
a(干燥气体) |
b(液体) |
| A |
NO2 |
水 |
| B |
CO2 |
4 mol·L-1NaOH溶液 |
| C |
Cl2 |
饱和NaCl水溶液 |
| D |
NH3 |
1 mol·L-1盐酸 |
已知25%氨水的密度为0.91 g·cm-3,5%氨水的密度为0.98 g·cm-3,若将上述两溶液等体积混合,所得氨水溶液的质量分数( )
| A.等于15% | B.大于15% | C.小于15% | D.无法估算 |
下列各组物质中分子、离子或晶体的空间结构完全不同的是( )
| A.NH3和H3O+ | B.N 和CH4 和CH4 |
C.CO2和SiO2 | D.金刚石和晶体硅 |
标准状况下,用一定量的水吸收氨气后制得浓度为12.0 mol·L-1,密度为0.915 g·cm-3的氨水。试计算1体积水吸收多少体积的氨气可制得上述氨水。〔已知ρ(水)="1.00" g·cm-3〕
下列离子方程式正确的是( )
A.硫酸铵溶液与氢氧化钡溶液共热 + + +Ba2++OH-====BaSO4↓+NH3↑+H2O +Ba2++OH-====BaSO4↓+NH3↑+H2O |
B.氯化铵溶液中加入稀氢氧化钠溶液 +OH-====NH3·H2O +OH-====NH3·H2O |
C.氯化铵固体和熟石灰共热 +OH-====NH3↑+H2O +OH-====NH3↑+H2O |
| D.碳酸铵溶液中通入足量二氧化碳 |
 +CO2+H2O====2H
+CO2+H2O====2H