溴的氧化性介于氯和碘之间。利用这一性质判断,下列说法正确的是
| A.Cl—、I—离子加入到含Br—的溶液中,均可以将Br—氧化为Br2 |
| B.将Cl2缓慢通入含有相同物质的量浓度的Br—、I—的混合溶液中,Br—先被氧化 |
| C.湿润的淀粉碘化钾试纸遇到氯气会变蓝色 |
| D.在KBr溶液中加入碘水,发生如下反应:2Br—+I2=2I—+Br2 |
某溶液中含有的溶质是FeBr2、FeI2 ,若先向该溶液中通人一定量的氧气.再向反应后的溶液中滴加KSCN溶液,溶液变为红色,则下列叙述正确的是
①原溶液中的Br-一定被氧化;
②通人氮气之后原溶液中的Fe2+一定有部分或全部被氧化;
③不能确定通入氯气后的落液中是否存在;
④若取少量所得溶液,再加入CCl4溶液充分振荡,静置、分液,向上层溶液中加入足量的AgNO3溶液,只产生白色沉淀,说明原溶液中的I-、Fe2+、Br-均被完全氧化
A.①②③ B.②③④ C.①③④ D①②③④。
化学方程式可简明地体现元素及其化合物的性质。
已知:
下列说法不正确是:
| A.酸性(水溶液):HSCN〉H2CO3〉HCN |
| B.还原性(碱性溶液):Fe(OH)2〉I—〉KIO3 |
| C.热稳定性:NaCl〉NaClO4〉NaClO |
| D.氧化性(酸性溶液):I2〉FeCl3〉Co(OH)3 |
下列实验中,依据实验操作及现象,得出的结论正确的是
| |
操作 |
现象 |
结论 |
| A |
将水蒸气通过灼热的铁粉 |
粉末变红 |
铁与水在高温下发生反应 |
| B |
将充满NO2的密闭玻璃球浸泡在热水中 |
红棕色变深 |
反应2NO2(g) N2O4(g);ΔH<0 N2O4(g);ΔH<0 |
| C |
将少量的溴水分别滴入FeCl2溶液、NaI溶液中,再分别滴加CCl4振荡 |
上层分别呈无色和紫红色 |
还原性:I->Br->Fe2+ |
| D |
向溶液X中加入稀盐酸,并将产生的无色气体通入澄清石灰水中 |
生成白色沉淀 |
溶液X中一定含有CO32-或SO32- |
已知反应:①Cl2 + 2KBr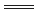 2KCl+Br2,②KClO3 +6HCl
2KCl+Br2,②KClO3 +6HCl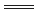 3Cl2+KCl +3H2O,
3Cl2+KCl +3H2O,
③2KBrO3 +Cl2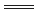 Br2 + 2KClO3,下列说法正确的是
Br2 + 2KClO3,下列说法正确的是
| A.上述三个反应都属于置换反应 |
| B.反应②中氧化剂与还原剂的物质的量之比为6∶1 |
| C.氧化性由强到弱顺序为 KBrO3>KClO3>Cl2>Br2 |
| D.反应③中若有lmol还原剂反应,则氧化剂得到电子的物质的量为2mol |
根据下列反应判断有关物质的还原性由强到弱的顺序正确的是
①
②
③
A. |
B. |
C. |
D. |
9.下列实验现象及相关的离子方程式均正确的是
| A.Cl2与FeI2溶液反应,当n(C12):n(FeI2)=1:1时:2Fe2++2I-+2C12 |
| B.向Ba(NO3)2溶液中通人SO2气体,出现白色沉淀:Ba2++SO2+ H2O |
| C.向H2O2溶液中滴加酸化的KMnO4溶液,KMnO4溶液褪色:2 MnO4+7 H2 O2+6 H+ |
D.将等物质的量浓度、等体积的Ba(OH)2溶液和NaHSO4溶液混合:Ba2++SO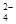 +H++OH- +H++OH- |
已知下列实验事实:
①Cr2O3固体既能溶于KOH溶液得到KCrO2溶液,又能溶于硫酸得到Cr2(SO4)3溶液;
②向KCrO2溶液中滴加H2O2溶液,再酸化,可得K2Cr2O7溶液;
③将K2Cr2O7溶液滴加到淀粉和KI的混合溶液中,溶液变蓝。
下列判断不正确的是
| A.化合物KCrO2中Cr元素为+3价 |
| B.实验①证明Cr2O3是两性氧化物 |
| C.实验②证明H2O2既有氧化性又有还原性 |
| D.实验③证明氧化性:Cr2O72— >I2 |
某溶液中含有Cl-与I-的浓度相同,为了氧化I-而不使Cl-氧化,试根据下列三个反应:
①2Fe3++2I-=2Fe2++I2;②2Fe2++Cl2=2Fe3++2Cl-
③2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O
判断可选用的氧化剂(氯气除外)是
| A.FeCl2 | B.KMnO4 | C.浓盐酸 | D.FeCl3 |
X、Y、Z、M代表四种金属元素,金属X和Z用导线连接放入稀硫酸中时,X溶解,Z极上有氢气放出;若电解Y2+和Z2+共存的溶液时,Y先析出;又知M2+的氧化性强于Y2+。则这四种金属的活动性由强到弱的顺序为
| A.X>Z>Y>M | B.X>Y>Z>M | C.M>Z>X>Y | D.X>Z>M>Y |
下列化学实验事实及其结论都正确的是
| 选项 |
实验事实 |
结论 |
| A |
将SO2通入含HClO的溶液中生成H2SO4 |
HClO的酸性比H2SO4强 |
| B |
铝箔在酒精灯火焰上加热熔化但不滴落 |
铝箔表面氧化铝熔点高于铝 |
| C |
SiO2可以和NaOH溶液及HF溶液反应 |
SiO2属于两性氧化物 |
| D |
将SO2通入溴水中,溴水褪色 |
SO2具有漂白性 |
Na2FeO4是一种新型水处理剂,可以通过下列反应制取:
湿法制备的主要反应方程为:2Fe(OH)3+3NaClO+4NaOH=2Na2FeO4+3NaCl+5H2O
干法制备的主要反应方程为:2FeSO4+4Na2O2=2Na2FeO4 +2Na2SO4
下列有关该反应的说法错误的是
| A.两反应中Na2FeO4均为氧化产物 |
| B.Na2FeO4有强氧化性,可消毒杀菌,其还原产物能吸附水中杂质 |
| C.干法中每生成1mol Na2FeO4转移3mol电子 |
| D.碱性条件下,NaClO氧化性大于Na2FeO4 |
现向含6 mol KI的硫酸溶液中逐滴加入KBrO3溶液,整个过程中含碘物质的物质的量与所加入KBrO3的物质的量的关系如图所示。
已知①BrO3-+6I一+6H+=3I2+Br-+3H2O;②2BrO3- +I2 = 2IO3-+ Br2;
请回答下列问题:
(1)b点时,KI反应完全,则消耗的氧化剂与还原剂物质的量之比为 ,还原产物是 。
(2)b→c过程中只有一种元素的化合价发生变化,写出该过程的离子反应方程式 。
(3)由反应②有同学由此得出氧化性:I2>Br2的结论,你认为是否正确,并说明理由 。
(4)含6 mol KI的硫酸溶液所能消耗n(KBrO3)的最大值为 。
(5)加碘食盐中含有碘酸钾(KIO3),现以电解法制备碘酸钾,实验装置如图所示。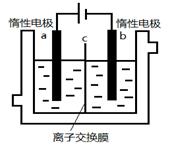
先将一定量的碘溶于过量氢氧化钾溶液,发生反应:3I2+6KOH=5KI+KIO3+3H2O,将该溶液加入阳极区,另将氢氧化钾溶液加入阴极区,开始电解。阳极的电极反应式为 。
已知氧化性:Cl2> Fe3+ >I2。向FeI2溶液中加入一定量的氯水,有关离子方程式错误的是
| A.2 I-+ Cl2 →I2 + 2Cl- |
| B.2Fe2+ + 2I-+ 2Cl2 → 2Fe3+ + I2 + 4Cl- |
| C.2Fe2+ + 4I-+ 3Cl2 → 2Fe3+ + 2I2 + 6Cl- |
| D.2Fe2+ + 6I-+ 4Cl2 → 2Fe3+ + 3I2 + 8Cl- |