是一种重要的杀菌消毒剂, 也常用来漂白织物等, 其一种生产工艺如下:
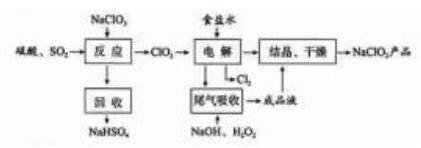
回答下列问题:
(1) 中 的化合价为_ 。
(2) 写出 "反应"步骤中生成 的化学方程式 。
(3) "电解"所用食盐水由粗盐水精制而成, 精制时,为除去 和 , 要加入的试剂分别为 、 。"电解" 中阴极反应的主要产物是_ 。
(4) "尾气吸收"是吸收 "电解"过程排出的少量 。此吸收反应中, 氧化剂与还原剂的
物质的量之比为 ,该反应中氧化产物 。
(5)"有效氯含量"可用来衡量含氯消毒剂的消毒能力, 其定义是:每克含氯消毒剂的氧化
能力相当于多少克 的氧化能力。 的有效氯含量为 。(计算结果保留两位小数)
氮的氧化物( )是大气污染物之一,工业上在一定温度和催化剂条件下用 将 还原生 成 , 某同学在实验室中对 与 反应进行了探究。回答下列问题:
(1)氨气的制备

①氨气的发生装置可以选择上图中的_ , 反应的化学方程式为_ 。
②预收集一瓶干燥的氨气,选择上图中的装置, 其连接顺序为: 发生装置→ (按气流方向, 用小写字母表示)。
(2)氨气与二氧化氮的反应
将上述收集到的 充入注射器 中, 硬质玻璃管 中加入少量催化剂, 充入 (两端用夹 子 夹好)。在一定温度下按图示装置进行实验。

| 操作步骤 |
实验现象 |
解释原因 |
| 打开 , 推动注射器活塞, 使 X中的气体缓慢通入 Y 管中 |
(1)Y 管中 |
(2反应的化学方程式 |
| 将注射器活塞退回原处并固 定, 待装置恢复到室温 |
Y 管中有少量水珠 |
生成的气态水凝集 |
| 打开 |
|
|
氧化石墨烯具有稳定的网状结构,在能源、材料等领域有着重要的应用前景。通过氧化剥离石墨制备氧化石墨烯的一种方法如下(装置如图所示):

Ⅰ.将浓 、 、石墨粉末在c中混合,置于冰水浴中。剧烈搅拌下,分批缓慢加入 粉末。塞好瓶口。
Ⅱ.转至油浴中, 搅拌1小时。缓慢滴加一定量的蒸馏水。升温至 并保持1小时。
Ⅲ.转移至大烧杯中,静置冷却至室温。加入大量蒸馏水,而后滴加 至悬浊液由紫色变为土黄色。
Ⅳ.离心分离,稀盐酸洗涤沉淀。
Ⅴ.蒸馏水洗涤沉淀。
Ⅵ.冷冻干燥,得到土黄色的氧化石墨烯。
回答下列问题:
(1)装置图中,仪器a、c的名称分别是 、 ,仪器b的进水口是 (填字母)。
(2)步骤Ⅰ中,需分批缓慢加入 粉末并使用冰水浴,原因是 。
(3)步骤Ⅱ中的加热方式采用油浴,不使用热水浴,原因是 。
(4)步骤Ⅲ中, 的作用是 (以离子方程式表示)。
(5)步骤Ⅳ中,洗涤是否完成,可通过检测洗出液中是否存在 来判断。检测的方法是 。
(6)步骤Ⅴ可用 试纸检测来判断 是否洗净,其理由是 。
磁选后的炼铁高钛炉渣,主要成分有 、 、 、 、 以及少量的 。为节约和充分利用资源,通过如下工艺流程回收钛、铝、镁等。
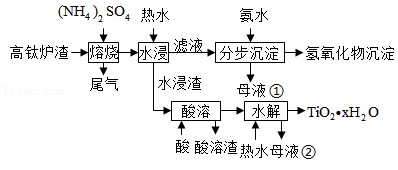
该工艺条件下,有关金属离子开始沉淀和沉淀完全的pH见下表
| 金属离子 |
|
|
|
|
| 开始沉淀的pH |
2.2 |
3.5 |
9.5 |
12.4 |
| 沉淀完全 的pH |
3.2 |
4.7 |
11.1 |
13.8 |
回答下列问题:
(1)"焙烧"中, 、 几乎不发生反应, 、 、 、 转化为相应的硫酸盐。写出 转化为 的化学方程式 。
(2)"水浸"后"滤液"的 约为2.0,在"分步沉淀"时用氨水逐步调节 至11.6,依次析出的金属离子是 。
(3)"母液①"中 浓度为 。
(4)"水浸渣"在 "酸溶",最适合的酸是 。"酸溶渣"的成分是 、 。
(5)"酸溶"后,将溶液适当稀释并加热, 水解析出 沉淀,该反应的离子方程式是 。
(6)将"母液①"和"母液②"混合,吸收尾气,经处理得 ,循环利用。
胆矾( )易溶于水,难溶于乙醇。某小组用工业废铜焙烧得到的 (杂质为氧化铁及泥沙)为原料与稀硫酸反应制备胆矾,并测定其结晶水的含量。回答下列问题:
(1)制备胆矾时,用到的实验仪器除量筒、酒精灯、玻璃棒、漏斗外,还必须使用的仪器有________(填标号)。
| A. |
烧杯 |
B. |
容量瓶 |
C. |
蒸发皿 |
D. |
移液管 |
(2)将 加入到适量的稀硫酸中,加热,其主要反应的化学方程式为___________,与直接用废铜和浓硫酸反应相比,该方法的优点是_________。
(3)待 完全反应后停止加热,边搅拌边加入适量 ,冷却后用 调 为3.5~4,再煮沸 ,冷却后过滤。滤液经如下实验操作:加热蒸发、冷却结晶、________、乙醇洗涤、________,得到胆矾。其中,控制溶液 为3.5~4的目的是_________,煮沸 的作用是_________。
(4)结晶水测定:称量干燥坩埚的质量为 ,加入胆矾后总质量为 ,将坩埚加热至胆矾全部变为白色,置于干燥器中冷至室温后称量,重复上述操作,最终总质量恒定为 。根据实验数据,胆矾分子中结晶水的个数为_________(写表达式)。
(5)下列操作中,会导致结晶水数目测定值偏高的是________(填标号)。
| A. |
①胆矾未充分干燥 |
| B. |
②坩埚未置于干燥器中冷却 |
| C. |
③加热时有少胆矾迸溅出来 |
碘(紫黑色固体,微溶于水)及其化合物广泛用于医药、染料等方面。回答下列问题:
(1) 的一种制备方法如下图所示:
①加入 粉进行转化反应的离子方程式为_________,生成的沉淀与硝酸反应,生成________后可循环使用。
②通入 的过程中,若氧化产物只有一种,反应的化学方程式为__________;若反应物用量比 时,氧化产物为_________;当 ,单质碘的收率会降低,原因是___________。
(2)以 为原料制备 的方法是:先向 溶液中加入计量的 ,生成碘化物;再向混合溶液中加入 溶液,反应得到 ,上述制备 的总反应的离子方程式为__________。
(3) 溶液和 溶液混合可生成 沉淀和 ,若生成 ,消耗的 至少为_______ 。 在 溶液中可发生反应: 。实验室中使用过量的 与 溶液反应后,过滤,滤液经水蒸气蒸馏可制得高纯碘。反应中加入过量 的原因是________。
以菱镁矿(主要成分为MgCO3,含少量SiO2、Fe2O3和Al2O3)为原料制备高纯镁砂的工艺流程如图:
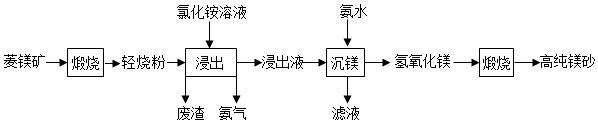
已知浸出时产生的废渣中有SiO2、Fe(OH)3 和Al(OH)3.下列说法错误的是( )
A.浸出镁的反应为MgO+2NH4Cl═MgCl2+2NH3↑+H2O
B.浸出和沉镁的操作均应在较高温度下进行
C.流程中可循环使用的物质有NH3、NH4Cl
D.分离Mg2+与Al3+、Fe3+是利用了它们氢氧化物Ksp的不同
化学工业为疫情防控提供了强有力的物质支撑。氯的许多化合物既是重要化工原料,又是高效、广谱的灭菌消毒剂。回答下列问题:
(1)氯气是制备系列含氯化合物的主要原料,可采用如图(a)所示的装置来制取。装置中的离子膜只允许 离子通过,氯气的逸出口是 (填标号)。
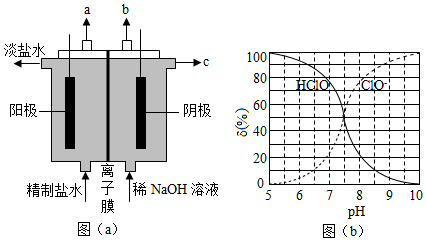
(2)次氯酸为一元弱酸,具有漂白和杀菌作用,其电离平衡体系中各成分的组成分数δ[δ(X) ,X为HClO或ClO ﹣]与pH的关系如图(b)所示。HClO的电离常数K a值为 。
(3)Cl 2O为淡棕黄色气体,是次氯酸的酸酐,可由新制的HgO和Cl 2反应来制备,该反应为歧化反应(氧化剂和还原剂为同一种物质的反应)。上述制备Cl 2O的化学方程式为 。
(4)ClO 2常温下为黄色气体,易溶于水,其水溶液是一种广谱杀菌剂。一种有效成分为NaClO 2、NaHSO 4、NaHCO 3的"二氧化氯泡腾片",能快速溶于水,溢出大量气泡,得到ClO 2溶液。上述过程中,生成ClO 2的反应属于歧化反应,每生成1mol ClO 2消耗NaClO 2的量为 mol;产生"气泡"的化学方程式为 。
(5)"84消毒液"的有效成分为NaClO,不可与酸性清洁剂混用的原因是 (用离子方程式表示)。工业上是将氯气通入到30%的NaOH溶液中来制备NaClO溶液,若NaClO溶液中NaOH的质量分数为1%,则生产1000kg该溶液需消耗氯气的质量为 kg(保留整数)。
钒具有广泛用途。黏土钒矿中,钒以+3、+4、+5价的化合物存在,还包括钾、镁的铝硅酸盐,以及SiO 2、Fe 3O 4。采用如图工艺流程可由黏土钒矿制备NH 4VO 3。
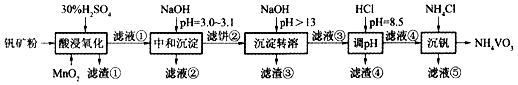
该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的pH如下表所示。
| 金属离子 |
Fe 3+ |
Fe 2+ |
Al 3+ |
Mn 2+ |
| 开始沉淀pH |
1.9 |
7.0 |
3.0 |
8.1 |
| 完全沉淀pH |
3.2 |
9.0 |
4.7 |
10.1 |
回答下列问题:
(1)"酸浸氧化"需要加热,其原因是 。
(2)"酸浸氧化"中,VO +和VO 2+被氧化成VO 2 +,同时还有 离子被氧化。写出VO +转化为VO 2 +反应的离子方程式 。
(3)"中和沉淀"中,钒水解并沉淀为V 2O 5•xH 2O,随滤液②可除去金属离子K +、Mg 2+、Na +、 ,以及部分的 。
(4)"沉淀转溶"中,V 2O 5•xH 2O转化为钒酸盐溶解。滤渣③的主要成分是 。
(5)"调pH"中有沉淀生产,生成沉淀反应的化学方程式是 。
吸收工厂烟气中的SO2,能有效减少SO2对空气的污染。氨水、ZnO水悬浊液吸收烟气中SO2后经O2催化氧化,可得到硫酸盐。
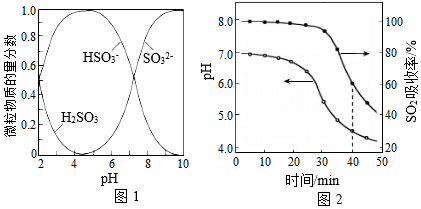
已知:室温下,ZnSO3微溶于水,Zn(HSO3)2易溶于水;溶液中H2SO3、HSO3﹣、SO32﹣的物质的量分数随pH的分布如图1所示。
(1)氨水吸收SO2.向氨水中通入少量SO2,主要反应的离子方程式为 ;当通入SO2至溶液pH=6时,溶液中浓度最大的阴离子是 (填化学式)。
(2)ZnO水悬浊液吸收SO2.向ZnO水悬浊液中匀速缓慢通入SO2,在开始吸收的40min内,SO2吸收率、溶液pH均经历了从几乎不变到迅速降低的变化(如图2)。溶液pH几乎不变阶段,主要产物是 ( 填化学式);SO2吸收率迅速降低阶段,主要反应的离子方程式为 。
(3)O2催化氧化。其他条件相同时,调节吸收SO2得到溶液的pH在4.5~6.5范围内,pH越低SO42﹣生成速率越大,其主要原因是 ;随着氧化的进行,溶液的pH将 (填“增大”、“减小”或“不变“)。
聚异丁烯是一种性能优异的功能高分子材料。某科研小组研究了使用特定引发剂、正己烷为溶剂、无水条件下异丁烯的聚合工艺。已知:异丁烯沸点266K。反应方程式及主要装置示意图如下:
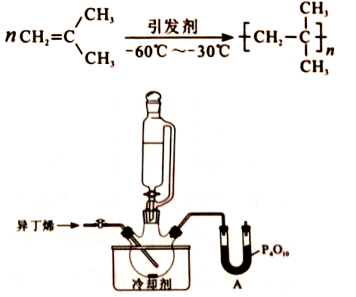
回答问题:
(1)仪器A的名称是 ,P 4O 10作用是 。
(2)将钠块加入正己烷中,除去微量的水,反应方程式为 .。
(3)浴槽中可选用的适宜冷却剂是 (填序号)。
| 序号 |
冷却剂 |
最低温度/℃ |
| 甲 |
NaCl﹣冰(质量比1:3) |
﹣21 |
| 乙 |
CaCl 2•6H 2O﹣冰(质量比1.43:1) |
﹣55 |
| 丙 |
液氨 |
﹣33 |
(4)补齐操作步骤
选项为:a.向三口瓶中通入一定量异丁烯
b.向三口瓶中加入一定量正己烷
① (填编号);
②待反应体系温度下降至既定温度;
③ (填编号);
④搅拌下滴加引发剂,一定时间后加入反应终止剂停止反应。经后续处理得成品。
(5)测得成品平均相对分子质量为2.8×10 6,平均聚合度为 。
以黄铁矿(主要成分FeS 2)为原料生产硫酸,应将产出的炉渣和尾气进行资源化综合利用,减轻对环境的污染。其中一种流程如图所示。

回答下列问题:
(1)黄铁矿中硫元素的化合价为 。
(2)由炉渣制备还原铁粉的化学方程式为 。
(3)欲得到更纯的NaHSO 3,反应①应通入 (填"过量"或"不足量")的SO 2气体。
(4)因为Na 2S 2O 5具有 性,导致商品Na 2S 2O 5中不可避免地存在Na 2SO 4。检验其中含有SO 4 2 ﹣的方法是 。
(5)一般用 K 2Cr 2O 7滴定分析法测定还原铁粉纯度。实验步骤:称取一定量样品,用过量稀硫酸溶解,用标准K 2Cr 2O 7溶液滴定其中的Fe 2+。
反应式:Cr 2O 7 2 ﹣+6Fe 2++14H +═2Cr 3++6Fe 3++7H 2O
某次实验称取0.2800g样品,滴定时消耗浓度为0.03000mol•L ﹣ 1的K 2Cr 2O 7溶液25.10mL,则样品中铁含量为 %。