砷(As)是第四周期VA族元素,可以形成 、 、 、 等化合物,有着广泛的用途。回答下列问题:
(1)画出砷的原子结构示意图__________。
(2)工业上常将含砷废渣(主要成分为 )制成浆状,通入 氧化,生成 和单质硫。写出发生反应的化学方程式__________。该反应需要在加压下进行,原因是__________。
(3)已知:
则反应 的 __________。
(4)298K时,将 、 和 溶液混合,发生反应: 。溶液中 与反应时间(t)的关系如图所示。
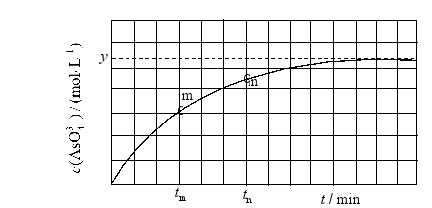
①下列可判断反应达到平衡的是__________(填标号)。
a.溶液的pH不再变化
b.
c. 不再变化
d.
② 时, __________ (填"大于"、"小于"或"等于")。
③ 时 __________ 时 (填"大于"、"小于"或"等于"),理由是__________。
④若平衡时溶液的 ,则该反应的平衡常数K为__________。
重铬酸钾是一种重要的化工原料,一般由铬铁矿制备,铬铁矿的主要成分为 ,还含有硅、铝等杂质。制备流程如图所示:

回答下列问题:
(1)步骤①的主要反应为:
上述反应配平后 与 的系数比为________。该步骤不能使用陶瓷容器,原因是________。
(2)滤渣1中含量最多的金属元素是________,滤渣2的主要成分是________及含硅杂质。
(3)步骤④调滤液2的 使之变________(填"大"或"小"),原因是________(用离子方程式表示)。
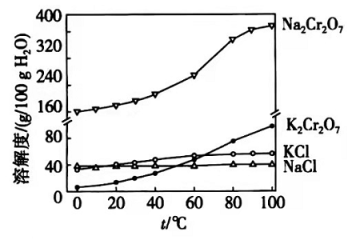
(4)有关物质的溶解度如图所示。向"滤液3"中加入适量 ,蒸发浓缩,冷却结晶,过滤得到 固体。冷却到________(填标号)得到的 固体产品最多。
a.
b.
c.
d.
步骤⑤的反应类型是________。
(5)某工厂用 铬铁矿粉(含 40%)制备 ,最终得到产品 ,产率为________。
绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究。回答下列问题:
(1)在试管中加入少量绿矾样品,加水溶解,滴加 溶液,溶液颜色无明显变化。再向试管中通入空气,溶液逐渐变红。由此可知:________、________。
(2)为测定绿矾中结晶水含量,将石英玻璃管(带两端开关 和 )(设为装置A)称重,记为 。将样品装入石英玻璃管中,再次将装置A称重,记为 。按下图连接好装置进行实验。
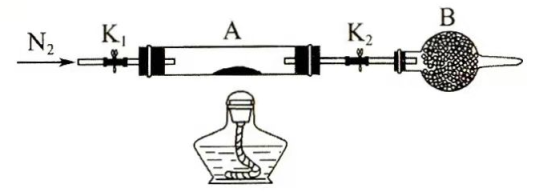
①仪器B的名称是________。
②将下列实验操作步骤正确排序________(填标号);重复上述操作步骤,直至A恒重,记为 。
a.点燃酒精灯,加热
b.熄灭酒精灯
c.关闭 和
d.打开 和 ,缓缓通入
e.称量Af.冷却到室温
③根据实验记录,计算绿矾化学式中结晶水数目 ________(列式表示)。若实验时按a、d次序操作,则使x________(填"偏大""偏小"或"无影响")。
(3)为探究硫酸亚铁的分解产物,将(2)中已恒重的装置A接入下图所示的装置中,打开 和 ,缓缓通入 ,加热。实验后反应管中残留固体为红色粉末。
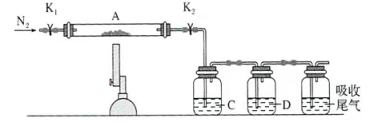
① 中的溶液依次为________(填标号)。 中有气泡冒出,并可观察到的现象分别为________。
a.品红
b.
c.
d.
e.浓
②写出硫酸亚铁高温分解反应的化学方程式________。
立德粉
(也称锌钡白),是一种常用白色颜料。回答下列问题:
(1)利用焰色反应的原理既可制作五彩缤纷的节日烟花,亦可定性鉴别某些金属盐。灼烧立德粉样品时,钡的焰色为__________(填标号)。
| A. | 黄色 |
| B. | 红色 |
| C. | 紫色 |
| D. | 绿色 |
(2)以重晶石( )为原料,可按如下工艺生产立德粉:
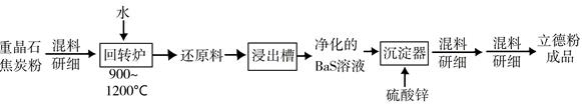
①在回转窑中重晶石被过量焦炭还原为可溶性硫化钡,该过程的化学方程式为________。回转窑尾气中含有有毒气体,生产上可通过水蒸气变换反应将其转化为 和一种清洁能源气体,该反应的化学方程式为________。
②在潮湿空气中长期放置的"还原料",会逸出臭鸡蛋气味的气体,且水溶性变差。其原因是"还原料"表面生成了难溶于水的________(填化学式)。
③沉淀器中反应的离子方程式为________。
(3)成品中 的含量可以用"碘量法"测得。称取 样品,置于碘量瓶中,移取 l的 溶液于其中,并加入乙酸溶液,密闭,置暗处反应 ,有单质硫析出。以淀粉溶液为指示剂,过量的 用 溶液滴定,反应式为 。测定时消耗 溶液体积 。终点颜色变化为________,样品中 的含量为________(写出表达式)。
下列化学方程式中,不能正确表达反应颜色变化的是( )
| A. |
向 溶液中加入足量Zn粉,溶液蓝色消失: |
| B. |
澄清的石灰水久置后出现白色固体: |
| C. |
在空气中放置后由淡黄色变为白色: |
| D. |
向 悬浊液中滴加足量 溶液出现红褐色沉淀: |
和 都是锂离子电池的电极材料,可利用钛铁矿(主要成分为 , 还含有少量MgO、 等杂质)来制备,工艺流程如下:
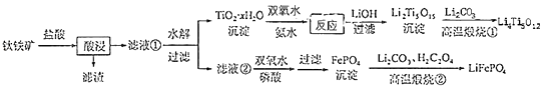
回答下列问题:
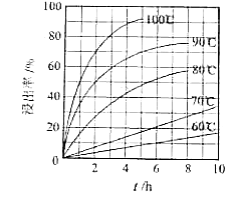
(1)"酸浸"实验中,铁的浸出率结果如下图所示.由图可知,当铁的净出率为70%时,所采用的实验条件为________.
(2)"酸浸"后,钛主要以 形式存在,写出相应反应的离子方程式________.
(3) 沉淀与双氧水、氨水反应40min所得实验结果如下表所示:
| 温度/℃ |
30 |
35 |
40 |
45 |
50 |
| 92 |
95 |
97 |
93 |
88 |
|
分析40℃时 转化率最高的原因________.
(4) 中Ti的化合价为+4,其中过氧键的数目为________.
(5)若"滤液②"中 , 加入双氧水和磷酸(设溶液体积增加1倍),使 恰好沉淀完全即溶液中 , 此时是否有 沉淀生成?________(列式计算). 、 的分别为 、
(6)写出"高温煅烧②"中由FePO 4制备 的化学方程式________.
凯氏定氨法是测定蛋白质中氮含量的经典方法,其原理是用浓硫酸在催化剂存在下将样品中有机氮转化成铵盐,利用如图所示装置处理铵盐,然后通过滴定测量.已知: .
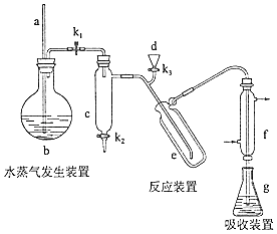
回答下列问题:
(1)a的作用是________.
(2)b中放入少量碎瓷片的目的是________.f的名称是________.
(3)清洗仪器:g中加蒸馏水:打开 , 关闭 、 , 加热b,蒸气充满管路:停止加热,关闭 , g中蒸馏水倒吸进入c,原因是________;打开 放掉水,重复操作2~3次.
(4)仪器清洗后,g中加入硼酸( )和指示剂,铵盐试样由d注入e,随后注入氢氧化钠溶液,用蒸馏水冲洗d,关闭 , d中保留少量水,打开 , 加热b,使水蒸气进入e.
①d中保留少量水的目的是________.
②e中主要反应的离子方程式为________,e采用中空双层玻璃瓶的作用是________.
(5)取某甘氨酸( )样品m 克进行测定,滴定g中吸收液时消耗浓度为 的盐酸 ,则样品中氮的质量分数为________%,样品的纯度≤________%.
丙烯腈(CH 2=CHCN)是一种重要的化工原料,工业上可用"丙烯氨氧化法"生产.主要副产物有丙烯醛(CH 2=CHCHO)和乙腈(CH 3CN)等。回答下列问题:
(1)以丙烯、氨、氧气为原料,在催化剂存在下生成丙烯腈(C 3H 3N)和副产物丙烯醛(C 3H 4O)。热化学方程式如下:①C 3H 6(g)+NH 3(g)+ O 2(g)═C 3H 3N(g)+3H 2O(g)△H=﹣515kJ•mol ﹣ 1
②C 3H 6(g)+O 2(g)═C 3H 4O(g)+H 2O(g)△H=﹣353kJ•mol ﹣ 1
两个反应在热力学上趋势均很大,其原因是________;有利于提高丙烯腈平衡产率的反应条件是________;提高丙烯腈反应选择性的关键因素是________.
(2)图(a)为丙烯腈产率与反应温度的关系曲线,最高产率对应的温度为460℃.低于460℃时,丙烯腈的产率________(填"是"或"不是")对应温度下的平衡转化率,判断理由是________;高于460℃时,丙烯腈产率降低的可能原因是________(双选,填标号).

| A. |
催化剂活性降低 |
B. |
平衡常数变大 |
| C. |
副反应增多 |
D. |
反应活化能增大 |
(3)丙烯腈和丙烯醛的产率与n(氨)/n(丙烯)的关系如图(b)所示.由图可知,最佳n(氨)/n(丙烯)约为________,理由是________.进料气氨、空气、丙烯的理论体积比约为________.
联氨(又称肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料.回答下列问题:
(1)联氨分子的电子式为________,其中氮的化合价为________.
(2)实验室中可用次氯酸钠溶液与氨反应制备联氨,反应的化学方程式为________.
(3)①2O2(g)+N2(g)═N2O4(l)△H1
②N2(g)+2H2(g)═N2H4(l)△H2
③O2(g)+2H2(g)═2H2O(g)△H3
④2N2H4(l)+N2O4(l)═3N2(g)+4H2O(g)△H4=﹣1048.9kJ•mol﹣1
上述反应热效应之间的关系式为△H4=________,联氨和N2O4可作为火箭推进剂的主要原因为________.
(4) 联氨为二元弱碱,在水中的电离方式与氨相似.联氨第一步电离反应的平衡常数值为________(已知:N2H4+H+⇌N2H5+的K=8.7×107;Kw=1.0×10﹣14).联氨与硫酸形成的酸式盐的化学式为________.
(5)联氨是一种常用的还原剂.向装有少量AgBr的试管中加入联氨溶液,观察到的现象是________.联氨可用于处理高压锅炉水中的氧,防止锅炉被腐蚀.理论上1kg的联氨可除去水中溶解的O2________kg;与使用Na2SO3处理水中溶解的O2相比,联氨的优点是________.
硼酸
是一种重要的化工原料,广泛应用于玻璃、医药、肥料等工艺。一种以硼镁矿(含
及少量
)为原料生产硼酸及轻质氧化镁的工艺流程如下:
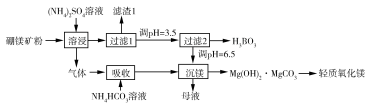
回答下列问题:
(1)在 "溶侵"硼镁矿粉,产生的气体在"吸收"中反应的化学方程式为_________。
(2)"滤渣1"的主要成分有_________。为检验"过滤1"后的滤液中是否含有 离子,可选用的化学试剂是_________。
(3)根据H3BO3的解离反应: , ,可判断 是_______酸;在"过滤2"前,将溶液pH调节至3.5,目的是_______________。
(4)在"沉镁"中生成 沉淀的离子方程式为__________,母液经加热后可返回___________工序循环使用。由碱式碳酸镁制备轻质氧化镁的方法是_________。
是一种重要的杀菌消毒剂, 也常用来漂白织物等, 其一种生产工艺如下:
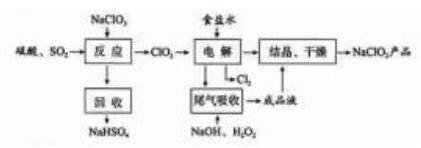
回答下列问题:
(1) 中 的化合价为_ 。
(2) 写出 "反应"步骤中生成 的化学方程式 。
(3) "电解"所用食盐水由粗盐水精制而成, 精制时,为除去 和 , 要加入的试剂分别为 、 。"电解" 中阴极反应的主要产物是_ 。
(4) "尾气吸收"是吸收 "电解"过程排出的少量 。此吸收反应中, 氧化剂与还原剂的
物质的量之比为 ,该反应中氧化产物 。
(5)"有效氯含量"可用来衡量含氯消毒剂的消毒能力, 其定义是:每克含氯消毒剂的氧化
能力相当于多少克 的氧化能力。 的有效氯含量为 。(计算结果保留两位小数)
氮的氧化物( )是大气污染物之一,工业上在一定温度和催化剂条件下用 将 还原生 成 , 某同学在实验室中对 与 反应进行了探究。回答下列问题:
(1)氨气的制备

①氨气的发生装置可以选择上图中的_ , 反应的化学方程式为_ 。
②预收集一瓶干燥的氨气,选择上图中的装置, 其连接顺序为: 发生装置→ (按气流方向, 用小写字母表示)。
(2)氨气与二氧化氮的反应
将上述收集到的 充入注射器 中, 硬质玻璃管 中加入少量催化剂, 充入 (两端用夹 子 夹好)。在一定温度下按图示装置进行实验。

| 操作步骤 |
实验现象 |
解释原因 |
| 打开 , 推动注射器活塞, 使 X中的气体缓慢通入 Y 管中 |
(1)Y 管中 |
(2反应的化学方程式 |
| 将注射器活塞退回原处并固 定, 待装置恢复到室温 |
Y 管中有少量水珠 |
生成的气态水凝集 |
| 打开 |
|
|
氧化石墨烯具有稳定的网状结构,在能源、材料等领域有着重要的应用前景。通过氧化剥离石墨制备氧化石墨烯的一种方法如下(装置如图所示):

Ⅰ.将浓 、 、石墨粉末在c中混合,置于冰水浴中。剧烈搅拌下,分批缓慢加入 粉末。塞好瓶口。
Ⅱ.转至油浴中, 搅拌1小时。缓慢滴加一定量的蒸馏水。升温至 并保持1小时。
Ⅲ.转移至大烧杯中,静置冷却至室温。加入大量蒸馏水,而后滴加 至悬浊液由紫色变为土黄色。
Ⅳ.离心分离,稀盐酸洗涤沉淀。
Ⅴ.蒸馏水洗涤沉淀。
Ⅵ.冷冻干燥,得到土黄色的氧化石墨烯。
回答下列问题:
(1)装置图中,仪器a、c的名称分别是 、 ,仪器b的进水口是 (填字母)。
(2)步骤Ⅰ中,需分批缓慢加入 粉末并使用冰水浴,原因是 。
(3)步骤Ⅱ中的加热方式采用油浴,不使用热水浴,原因是 。
(4)步骤Ⅲ中, 的作用是 (以离子方程式表示)。
(5)步骤Ⅳ中,洗涤是否完成,可通过检测洗出液中是否存在 来判断。检测的方法是 。
(6)步骤Ⅴ可用 试纸检测来判断 是否洗净,其理由是 。
磁选后的炼铁高钛炉渣,主要成分有 、 、 、 、 以及少量的 。为节约和充分利用资源,通过如下工艺流程回收钛、铝、镁等。
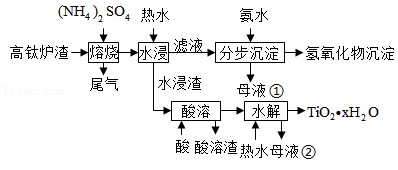
该工艺条件下,有关金属离子开始沉淀和沉淀完全的pH见下表
| 金属离子 |
|
|
|
|
| 开始沉淀的pH |
2.2 |
3.5 |
9.5 |
12.4 |
| 沉淀完全 的pH |
3.2 |
4.7 |
11.1 |
13.8 |
回答下列问题:
(1)"焙烧"中, 、 几乎不发生反应, 、 、 、 转化为相应的硫酸盐。写出 转化为 的化学方程式 。
(2)"水浸"后"滤液"的 约为2.0,在"分步沉淀"时用氨水逐步调节 至11.6,依次析出的金属离子是 。
(3)"母液①"中 浓度为 。
(4)"水浸渣"在 "酸溶",最适合的酸是 。"酸溶渣"的成分是 、 。
(5)"酸溶"后,将溶液适当稀释并加热, 水解析出 沉淀,该反应的离子方程式是 。
(6)将"母液①"和"母液②"混合,吸收尾气,经处理得 ,循环利用。
胆矾( )易溶于水,难溶于乙醇。某小组用工业废铜焙烧得到的 (杂质为氧化铁及泥沙)为原料与稀硫酸反应制备胆矾,并测定其结晶水的含量。回答下列问题:
(1)制备胆矾时,用到的实验仪器除量筒、酒精灯、玻璃棒、漏斗外,还必须使用的仪器有________(填标号)。
| A. |
烧杯 |
B. |
容量瓶 |
C. |
蒸发皿 |
D. |
移液管 |
(2)将 加入到适量的稀硫酸中,加热,其主要反应的化学方程式为___________,与直接用废铜和浓硫酸反应相比,该方法的优点是_________。
(3)待 完全反应后停止加热,边搅拌边加入适量 ,冷却后用 调 为3.5~4,再煮沸 ,冷却后过滤。滤液经如下实验操作:加热蒸发、冷却结晶、________、乙醇洗涤、________,得到胆矾。其中,控制溶液 为3.5~4的目的是_________,煮沸 的作用是_________。
(4)结晶水测定:称量干燥坩埚的质量为 ,加入胆矾后总质量为 ,将坩埚加热至胆矾全部变为白色,置于干燥器中冷至室温后称量,重复上述操作,最终总质量恒定为 。根据实验数据,胆矾分子中结晶水的个数为_________(写表达式)。
(5)下列操作中,会导致结晶水数目测定值偏高的是________(填标号)。
| A. |
①胆矾未充分干燥 |
| B. |
②坩埚未置于干燥器中冷却 |
| C. |
③加热时有少胆矾迸溅出来 |