重铬酸钾是一种重要的化工原料,一般由铬铁矿制备,铬铁矿的主要成分为 ,还含有硅、铝等杂质。制备流程如图所示:

回答下列问题:
(1)步骤①的主要反应为:
上述反应配平后 与 的系数比为________。该步骤不能使用陶瓷容器,原因是________。
(2)滤渣1中含量最多的金属元素是________,滤渣2的主要成分是________及含硅杂质。
(3)步骤④调滤液2的 使之变________(填"大"或"小"),原因是________(用离子方程式表示)。
(4)有关物质的溶解度如图所示。向"滤液3"中加入适量 ,蒸发浓缩,冷却结晶,过滤得到 固体。冷却到________(填标号)得到的 固体产品最多。
a.
b.
c.
d.
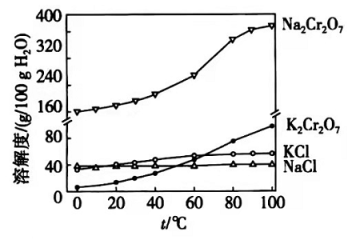
步骤⑤的反应类型是________。
(5)某工厂用 铬铁矿粉(含 40%)制备 ,最终得到产品 ,产率为________。
绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究。回答下列问题:
(1)在试管中加入少量绿矾样品,加水溶解,滴加 溶液,溶液颜色无明显变化。再向试管中通入空气,溶液逐渐变红。由此可知:________、________。
(2)为测定绿矾中结晶水含量,将石英玻璃管(带两端开关 和 )(设为装置A)称重,记为 。将样品装入石英玻璃管中,再次将装置A称重,记为 。按下图连接好装置进行实验。
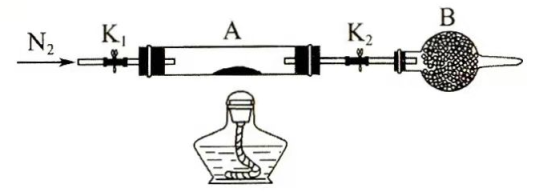
①仪器B的名称是________。
②将下列实验操作步骤正确排序________(填标号);重复上述操作步骤,直至A恒重,记为 。
a.点燃酒精灯,加热
b.熄灭酒精灯
c.关闭 和
d.打开 和 ,缓缓通入
e.称量Af.冷却到室温
③根据实验记录,计算绿矾化学式中结晶水数目 ________(列式表示)。若实验时按a、d次序操作,则使x________(填"偏大""偏小"或"无影响")。
(3)为探究硫酸亚铁的分解产物,将(2)中已恒重的装置A接入下图所示的装置中,打开 和 ,缓缓通入 ,加热。实验后反应管中残留固体为红色粉末。
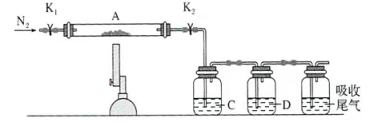
① 中的溶液依次为________(填标号)。 中有气泡冒出,并可观察到的现象分别为________。
a.品红
b.
c.
d.
e.浓
②写出硫酸亚铁高温分解反应的化学方程式________。
立德粉
(也称锌钡白),是一种常用白色颜料。回答下列问题:
(1)利用焰色反应的原理既可制作五彩缤纷的节日烟花,亦可定性鉴别某些金属盐。灼烧立德粉样品时,钡的焰色为__________(填标号)。
| A. | 黄色 |
| B. | 红色 |
| C. | 紫色 |
| D. | 绿色 |
(2)以重晶石( )为原料,可按如下工艺生产立德粉:
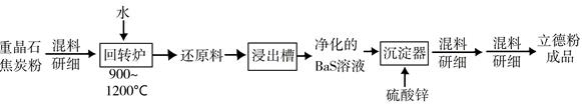
①在回转窑中重晶石被过量焦炭还原为可溶性硫化钡,该过程的化学方程式为________。回转窑尾气中含有有毒气体,生产上可通过水蒸气变换反应将其转化为 和一种清洁能源气体,该反应的化学方程式为________。
②在潮湿空气中长期放置的"还原料",会逸出臭鸡蛋气味的气体,且水溶性变差。其原因是"还原料"表面生成了难溶于水的________(填化学式)。
③沉淀器中反应的离子方程式为________。
(3)成品中 的含量可以用"碘量法"测得。称取 样品,置于碘量瓶中,移取 l的 溶液于其中,并加入乙酸溶液,密闭,置暗处反应 ,有单质硫析出。以淀粉溶液为指示剂,过量的 用 溶液滴定,反应式为 。测定时消耗 溶液体积 。终点颜色变化为________,样品中 的含量为________(写出表达式)。
化合物H是一种有机光电材料中间体.实验室由芳香化合物A制备H的一种合成路线如下:
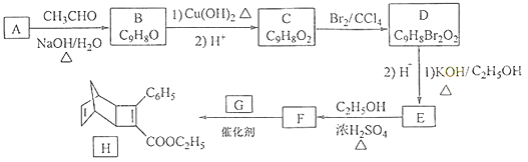
已知:①
② 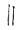 +
+ 

回答下列问题:
(1)A的化学名称为为________.
(2)由C生成D和E生成F的反应类型分别为________、________.
(3)E的结构简式为________.
(4)G为甲苯的同分异构体,由F生成H的化学方程式为________.
(5)芳香化合物X是F的同分异构体,X能与饱和碳酸氢钠溶液反应放出 , 其核磁共振氢谱显示有4种不同化学环境的氢,峰面积比为6:2:1:1,写出2种符合要求的X的结构简式________.
(6)写出用环戊烷和2﹣丁炔为原料制备化合物 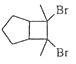 的合成路线________(其他试剂任选).
的合成路线________(其他试剂任选).
和 都是锂离子电池的电极材料,可利用钛铁矿(主要成分为 , 还含有少量MgO、 等杂质)来制备,工艺流程如下:
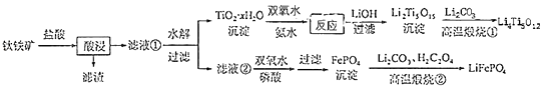
回答下列问题:
(1)"酸浸"实验中,铁的浸出率结果如下图所示.由图可知,当铁的净出率为70%时,所采用的实验条件为________.
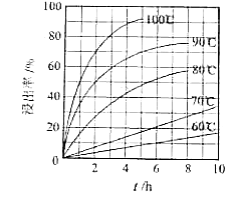
(2)"酸浸"后,钛主要以 形式存在,写出相应反应的离子方程式________.
(3) 沉淀与双氧水、氨水反应40min所得实验结果如下表所示:
| 温度/℃ |
30 |
35 |
40 |
45 |
50 |
| 92 |
95 |
97 |
93 |
88 |
|
分析40℃时 转化率最高的原因________.
(4) 中Ti的化合价为+4,其中过氧键的数目为________.
(5)若"滤液②"中 , 加入双氧水和磷酸(设溶液体积增加1倍),使 恰好沉淀完全即溶液中 , 此时是否有 沉淀生成?________(列式计算). 、 的分别为 、
(6)写出"高温煅烧②"中由FePO 4制备 的化学方程式________.
凯氏定氨法是测定蛋白质中氮含量的经典方法,其原理是用浓硫酸在催化剂存在下将样品中有机氮转化成铵盐,利用如图所示装置处理铵盐,然后通过滴定测量.已知: .
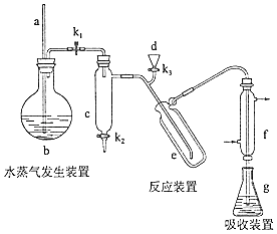
回答下列问题:
(1)a的作用是________.
(2)b中放入少量碎瓷片的目的是________.f的名称是________.
(3)清洗仪器:g中加蒸馏水:打开 , 关闭 、 , 加热b,蒸气充满管路:停止加热,关闭 , g中蒸馏水倒吸进入c,原因是________;打开 放掉水,重复操作2~3次.
(4)仪器清洗后,g中加入硼酸( )和指示剂,铵盐试样由d注入e,随后注入氢氧化钠溶液,用蒸馏水冲洗d,关闭 , d中保留少量水,打开 , 加热b,使水蒸气进入e.
①d中保留少量水的目的是________.
②e中主要反应的离子方程式为________,e采用中空双层玻璃瓶的作用是________.
(5)取某甘氨酸( )样品m 克进行测定,滴定g中吸收液时消耗浓度为 的盐酸 ,则样品中氮的质量分数为________%,样品的纯度≤________%.
水煤气变换
是重要的化工过程,主要用于合成氨、制氢以及合成气加工等工业领域中。回答下列问题:
(1)Shibata曾做过下列实验:①使纯 缓慢地通过处于 下的过量氧化钴 ,氧化钴部分被还原为金属钴 ,平衡后气体中 的物质的量分数为0.0250。
②在同一温度下用 还原 ,平衡后气体中 的物质的量分数为0.0192。
根据上述实验结果判断,还原 为 的倾向是 _________(填"大于"或"小于") 。
(2) 时,在密闭容器中将等物质的量的 和 混合,采用适当的催化剂进行反应,则平衡时体系中 的物质的量分数为_________(填标号)。
A. B. C. D. E.
(3)我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换的反应历程,如图所示,其中吸附在金催化剂表面上的物种用*标注。

可知水煤气变换的 ________(填"大于""等于"或"小于")0。该历程中最大能垒(活化能) =_________ ,写出该步骤的化学方程式_______________________。
(4)Shoichi研究了 时水煤气变换中 和 分压随时间变化关系(如图所示)催化剂为氧化铁,实验初始时体系中的 和 相等、 和 相等。
计算曲线a的反应在 内的平均速率 (a)=___________ 。 时 和 随时间变化关系的曲线分别是_______、_______。 时 和 随时间变化关系曲线分别是 、 。

硼酸
是一种重要的化工原料,广泛应用于玻璃、医药、肥料等工艺。一种以硼镁矿(含
及少量
)为原料生产硼酸及轻质氧化镁的工艺流程如下:
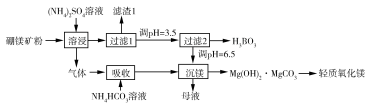
回答下列问题:
(1)在 "溶侵"硼镁矿粉,产生的气体在"吸收"中反应的化学方程式为_________。
(2)"滤渣1"的主要成分有_________。为检验"过滤1"后的滤液中是否含有 离子,可选用的化学试剂是_________。
(3)根据H3BO3的解离反应: , ,可判断 是_______酸;在"过滤2"前,将溶液pH调节至3.5,目的是_______________。
(4)在"沉镁"中生成 沉淀的离子方程式为__________,母液经加热后可返回___________工序循环使用。由碱式碳酸镁制备轻质氧化镁的方法是_________。
氮的氧化物( )是大气污染物之一,工业上在一定温度和催化剂条件下用 将 还原生 成 , 某同学在实验室中对 与 反应进行了探究。回答下列问题:
(1)氨气的制备

①氨气的发生装置可以选择上图中的_ , 反应的化学方程式为_ 。
②预收集一瓶干燥的氨气,选择上图中的装置, 其连接顺序为: 发生装置→ (按气流方向, 用小写字母表示)。
(2)氨气与二氧化氮的反应
将上述收集到的 充入注射器 中, 硬质玻璃管 中加入少量催化剂, 充入 (两端用夹 子 夹好)。在一定温度下按图示装置进行实验。

| 操作步骤 |
实验现象 |
解释原因 |
| 打开 , 推动注射器活塞, 使 X中的气体缓慢通入 Y 管中 |
(1)Y 管中 |
(2反应的化学方程式 |
| 将注射器活塞退回原处并固 定, 待装置恢复到室温 |
Y 管中有少量水珠 |
生成的气态水凝集 |
| 打开 |
|
|
氧化石墨烯具有稳定的网状结构,在能源、材料等领域有着重要的应用前景。通过氧化剥离石墨制备氧化石墨烯的一种方法如下(装置如图所示):

Ⅰ.将浓 、 、石墨粉末在c中混合,置于冰水浴中。剧烈搅拌下,分批缓慢加入 粉末。塞好瓶口。
Ⅱ.转至油浴中, 搅拌1小时。缓慢滴加一定量的蒸馏水。升温至 并保持1小时。
Ⅲ.转移至大烧杯中,静置冷却至室温。加入大量蒸馏水,而后滴加 至悬浊液由紫色变为土黄色。
Ⅳ.离心分离,稀盐酸洗涤沉淀。
Ⅴ.蒸馏水洗涤沉淀。
Ⅵ.冷冻干燥,得到土黄色的氧化石墨烯。
回答下列问题:
(1)装置图中,仪器a、c的名称分别是 、 ,仪器b的进水口是 (填字母)。
(2)步骤Ⅰ中,需分批缓慢加入 粉末并使用冰水浴,原因是 。
(3)步骤Ⅱ中的加热方式采用油浴,不使用热水浴,原因是 。
(4)步骤Ⅲ中, 的作用是 (以离子方程式表示)。
(5)步骤Ⅳ中,洗涤是否完成,可通过检测洗出液中是否存在 来判断。检测的方法是 。
(6)步骤Ⅴ可用 试纸检测来判断 是否洗净,其理由是 。
化学工业为疫情防控提供了强有力的物质支撑。氯的许多化合物既是重要化工原料,又是高效、广谱的灭菌消毒剂。回答下列问题:
(1)氯气是制备系列含氯化合物的主要原料,可采用如图(a)所示的装置来制取。装置中的离子膜只允许 离子通过,氯气的逸出口是 (填标号)。
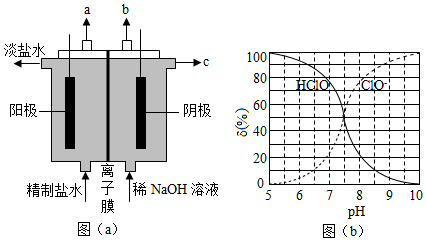
(2)次氯酸为一元弱酸,具有漂白和杀菌作用,其电离平衡体系中各成分的组成分数δ[δ(X) ,X为HClO或ClO ﹣]与pH的关系如图(b)所示。HClO的电离常数K a值为 。
(3)Cl 2O为淡棕黄色气体,是次氯酸的酸酐,可由新制的HgO和Cl 2反应来制备,该反应为歧化反应(氧化剂和还原剂为同一种物质的反应)。上述制备Cl 2O的化学方程式为 。
(4)ClO 2常温下为黄色气体,易溶于水,其水溶液是一种广谱杀菌剂。一种有效成分为NaClO 2、NaHSO 4、NaHCO 3的"二氧化氯泡腾片",能快速溶于水,溢出大量气泡,得到ClO 2溶液。上述过程中,生成ClO 2的反应属于歧化反应,每生成1mol ClO 2消耗NaClO 2的量为 mol;产生"气泡"的化学方程式为 。
(5)"84消毒液"的有效成分为NaClO,不可与酸性清洁剂混用的原因是 (用离子方程式表示)。工业上是将氯气通入到30%的NaOH溶液中来制备NaClO溶液,若NaClO溶液中NaOH的质量分数为1%,则生产1000kg该溶液需消耗氯气的质量为 kg(保留整数)。
聚异丁烯是一种性能优异的功能高分子材料。某科研小组研究了使用特定引发剂、正己烷为溶剂、无水条件下异丁烯的聚合工艺。已知:异丁烯沸点266K。反应方程式及主要装置示意图如下:
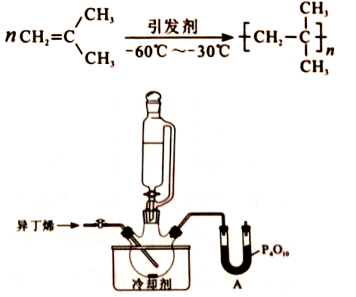
回答问题:
(1)仪器A的名称是 ,P 4O 10作用是 。
(2)将钠块加入正己烷中,除去微量的水,反应方程式为 .。
(3)浴槽中可选用的适宜冷却剂是 (填序号)。
| 序号 |
冷却剂 |
最低温度/℃ |
| 甲 |
NaCl﹣冰(质量比1:3) |
﹣21 |
| 乙 |
CaCl 2•6H 2O﹣冰(质量比1.43:1) |
﹣55 |
| 丙 |
液氨 |
﹣33 |
(4)补齐操作步骤
选项为:a.向三口瓶中通入一定量异丁烯
b.向三口瓶中加入一定量正己烷
① (填编号);
②待反应体系温度下降至既定温度;
③ (填编号);
④搅拌下滴加引发剂,一定时间后加入反应终止剂停止反应。经后续处理得成品。
(5)测得成品平均相对分子质量为2.8×10 6,平均聚合度为 。