价类二维图反映的是元素的化合价与物质类别之间的关系,构建价类二维图是化学学习的重要方法。如图甲是关于氮元素的价类二维图。
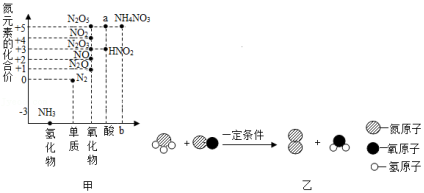
(1)图甲中,a物质的化学式是 ,b处对应的物质类别是 。
(2)价类二维图中的物质在一定条件下可以相互转化。石油中的氮元素在一定条件下能转化为氨气和一氧化氮(一氧化氮是汽车尾气成分之一),这两种气体混合发生反应的微观示意图如图乙所示。该反应的化学方程式是 ,此反应可以用于汽车尾气处理,其优点是 (写出一条即可)。
某兴趣小组为探究甲烷的元素组成,经查询资料,采用如图所示装置,制取并收集一定量甲烷气体进行实验。
【查询资料】
Ⅰ.甲烷是一种无色无味的气体,密度比空气小,难溶于水、有可燃性。
Ⅱ.实验室常用醋酸钠和碱石灰固体共热制取甲烷,有关反应的化学反应方程式:CH3COONa+NaOH Na2CO3+CH4↑。
Na2CO3+CH4↑。
【实验装置】
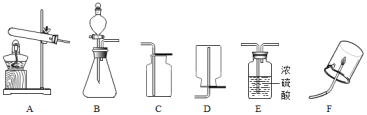
请回答:
(1)实验室制取甲烷气体应选用的发生装置是 (填序号,下同),收集装置是 ;
(2)验纯后,点燃甲烷气体,在火焰上方罩一冷而干燥的烧杯(见图F),烧杯内壁有
生成,然后向烧杯中倒入少量澄清石灰水,振荡,现象为 。由此推断,甲烷中一定含C、H两种元素,甲烷燃烧的化学反应方程式为 ;
(3)进行实验(2)前,将甲烷气体通过装置E,目的是 。
下列化学方程式的书写和对反应类型的判断,都正确的是( )
A.2FeCl3+Fe═3FeCl2 化合反应
B.HgO Hg+O2↑ 分解反应
Hg+O2↑ 分解反应
C.CuO+CO Cu+CO2 置换反应
Cu+CO2 置换反应
D.KCl+HNO3═KNO3+HCl 复分解反应
小明用含碳酸钠的氢氧化钠样品进行了如图所示的实验。请回答:

(1)此实验中发生反应的化学方程式是 ;
(2)过滤后滤液中溶质为 ,其质量分数是 。
化学就在我们身边,人类的生活离不开化学。请回答下列问题:
(1)饮用水硬度过大会影响人体健康。生活中降低水硬度常用的方法是 ;
(2)人们每天需要从食物中摄取充足的营养素。下列食物中富含蛋白质的是 ;
A.馒头
B.西红柿
C.牛肉
D.黄花鱼
(3)下列物质可用作食品干燥剂的是 ;
A.生石灰
B.熟石灰
C.火碱
D.纯碱
(4)未经处理的煤燃烧产生的 (写化学式)排放到空气中,会形成酸雨;
(5)甲醛(CH2O)为室内装修产生的有害物质之一。为去除污染,科学家研制出一种新型的催化剂,在其催化作用下,甲醛与空气中的氧气反应生成两种最常见的氧化物,该反应的化学方程式为 。
如图是实验室制取气体的常用装置。请回答。
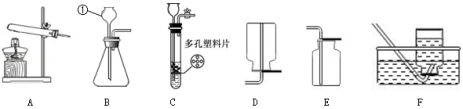
(1)用A装置制取氧气发生反应的化学方程式为 。
(2)用B装置制取氧气所需的药品是 。用该装置制取氧气时,若要得到平稳的气流,可将仪器①更换成 。
(3)制取二氧化碳气体若需随时控制反应的发生和停止,可选择的装置组合是 。
阅读下面科普短文,并根据文章内容,回答相关问题。
铝(Al)是自然界中含量最多的金属元素,其主要存在于硅铝酸盐中。铝也是活泼金属,常温下在空气中铝的表面会形成致密的氧化膜,使铝不会进一步氧化并能耐腐蚀。因此,铝粉常用来做涂料,俗称银粉、银漆,以保护铁制品不被锈蚀,而且美观。
铝的密度很小,仅为2.7g/cm3,质地较软,可制成硬铝、超硬铝、防锈铝等各种铝合金。汽车、火车、船舶、宇宙火箭、航天飞机、人造卫星等,也是用大量的铝及其合金制造而成的。如一架超音速飞机约由70%的铝及其合金制成。
铝热法是以铝粉为还原剂的一种金属热还原法,当铝粉与金属氧化物起反应时,产生足够的热量,使生成的金属(或合金)和其他成分熔融分离而获得金属(或合金),广泛应用于生产纯金属、低碳铁合金,以及焊接金属(如铁轨)等。焊接铁轨时发生的化学反应为:2Al+Fe2O3 2Fe+Al2O3,该反应产生大量的热,温度可达2000℃以上。
2Fe+Al2O3,该反应产生大量的热,温度可达2000℃以上。
(1)“银粉”、“银漆”保护铁制品不被锈蚀的原因是是隔绝了 。
(2)铝合金制造超音速飞机是利用了铝合金 的性质。
(3)铝热法焊接铁轨时所发生的反应属于 (填基本反应类型)。
(4)高炉炼铁的主要原理同样是运用了热还原法,写出以赤铁矿为原料炼铁的化学方程式: 。
阅读下列科普短文,回答有关问题。
石灰岩中悄悄发生的化学变化
石灰石是地壳中最常见的岩石之一,在石灰岩地区,地下水中溶解有较多的二氧化碳气体,石灰岩在地下水的不断侵蚀下逐渐溶解,经过漫长的过程形成溶洞。坚硬的石灰石主要成分是碳酸钙,水不会使它溶解,但溶解有较多二氧化碳的水可以慢慢和它发生化学反应,把它转化为可以溶解的碳酸氢钙[Ca(HCO3)2],溶解在地下水中。
溶解有较多碳酸氢钙的地下水,在一定条件下会逐渐分解,把“吃掉”的石灰岩重新“吐”出来,形成碳酸钙沉积下来,形成了钟乳石。检验碳酸钙的方法很简单,碳酸钙会在酸性条件下反应生成二氧化碳。我们日常烧水的水壶中经常会结接一些水垢,主要成分也是碳酸钙,倒入食醋进去就可以除水垢,利用也是一样的原理。
钟乳石非常漂亮,可以用来做人造假山,雕刻大尊工艺品等。可是钟乳石的形成周期非常长,需要上万年才能形成。溶洞景观一旦破坏,想要恢复几乎是不可能的,需要政府加强立法,保护钟乳石资源。
(1)在石灰岩地区,地下水的pH 7(填:“>”、“<”或“=”)。
(2)写出碳酸钙转化为碳酸氢钙的化学方程式 。
(3)可以向地下水的水样中加入 ,检验其为硬水还是软水。
(4)下列有关钟乳石的说法中,正确的是 (填字母序号)。
A.形成周期很长
B.能和食醋反应
C.资源丰富,可以任意开采
天然气(主要成分为CH4)作为清洁能源,正逐步走进城乡居民生活。
(1)“西气东输”工程利于国家能源和产业结构调整,极大改善了沿线居民生活质量。
①为防止传输天然气的钢管被腐蚀,可采取的措施有 (写出一种)。
②CH4完全燃烧的化学方程式是 ,该过程 (填“释放”或“吸收”)能量。
③天然气的使用可有效减少酸雨形成。下列现象与酸雨有关的是 。
A.石刻文物被腐蚀
B.全球海平面上升
(2)工业上以CH4为原料生产H2,制取原理如图所示:

已知变换塔、洗涤塔发生的主要反应依次是:CO+H2O CO2+H2,CO2+H2O═H2CO3。
CO2+H2,CO2+H2O═H2CO3。
①“转化炉”中有H2产生,参加反应的CH4与H2O的质量比 = 。
= 。
②“洗涤塔”中气体从塔底通入,水从塔顶喷淋。这样操作的优点是 。
③若有32g CH4参与反应(假设各步反应都完全转化),理论上可制得 g H2。
(3)我国是世界上首个成功试采海域可燃冰的国家。可燃冰是CH4被H2O分子形成的笼包裹,在海底低温和高压作用下形成的结晶物质。
①可燃冰样品常存放于液氮储存罐中,其原因是 。
②可燃冰有多种结构,某H型可燃冰的化学式为CH4•9H2O,分析其结构发现:平均34个H2O分子构成6个笼,每个笼只容纳一个CH4或H2O分子。这6个笼内容纳的CH4与H2O分子个数比是 (填最小整数比)。

扬州被称为运河之都、文化之都和美食之都,自古人文荟萃。
(1)故人西辞黄鹤楼,烟花三月下扬州。﹣﹣唐•李白
①孟浩然“下扬州”的交通工具是木船。现代游船常用玻璃钢制造船体,玻璃钢属于
(填“复合材料”或“金属材料”)。
②现代人远行可乘坐飞机。铝锂合金材料大量运用于国产C919大飞机的制造,下列不属于铝锂合金性质的是 (填字母)。
A.密度大
B.硬度大
C.抗腐蚀
③汽车是重要的陆路交通工具。燃油车辆须加装尾气催化净化装置,该装置将尾气中的CO和NO转化成CO2和一种无污染的气体,发生反应的化学方程式是 。
(2)天下三分明月夜,二分无赖是扬州。﹣﹣唐•徐凝
①空气质量影响人们观赏明月。空气属于 (填“混合物”或“纯净物”)。
②下列做法不利于改善空气质量的是 (填字母)。
A.风力发电
B.徒步出行
C.垃圾露天焚烧
③煤的气化和液化可实现能源清洁化,改善空气质量。水煤气中CO和H2在高温、高压和催化剂条件下合成甲醇(CH4O),该反应的化学方程式是 。
(3)前日扬州去,酒熟美蟹蜊。﹣﹣宋•梅尧臣
①蟹肉鲜美,富含蛋白质。蛋白质水溶液在加热时会生成沉淀,此沉淀 (填“能”或“不能”)重新溶解于水中。
②各种酒中都含有乙醇(C2H6O)。在酿酒过程中,粮食中的 (填糖类名称)先转化为葡萄糖,再经发酵生成乙醇。
③下列食品中富含维生素C的是 (填字母)。
A.盐水鹅
B.西红柿
C.大虾
请根据下列实验装置图回答问题。
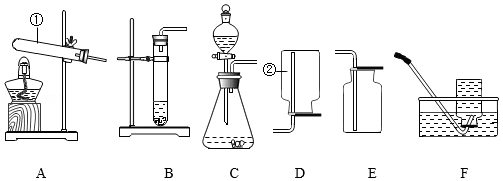
(1)写出标号仪器的名称:①是 ,②是 。能用装置E收集的气体应具有的性质是 。
(2)实验室用过氧化氢溶液和MnO2混合制O2时MnO2的作用是 。收集较纯净的氧气,装置可用 (填字母)。用锌与稀硫酸反应制取氢气的化学方程式为 。
(3)实验室可用铜片与浓硝酸在常温下反应制取少量二氧化氮(NO2)。通常状况下,二氧化氮是红棕色气体,溶于水时与水反应生成硝酸和一氧化氨(NO)。
①制取NO2的发生装置可用 (填字母)。
②收集NO2不用装置F的原因是 (用化学方程式表示)。
乘坐高铁是一种方便快捷的出行方式。
(1)高铁上提供的食物中,富含蛋白质的是 (从“饼干”、“牛奶”、“糖果”中选填)。
(2)高铁上提供的某品牌矿泉水中除水之外还含有硫酸镁、氯化钾等物质。硫酸镁中阳离子的符号为 ,氯化钾中阴离子的结构示意图为 。
(3)疫情期间乘坐髙铁出行需佩戴口罩。医用口罩的中间层是聚丙烯熔喷布,起过滤病毒作用。聚丙烯属于 (填“合成”或“复合”)材料。
(4)高铁列车的车体建设需消耗大量的铝合金和钢铁。工业上用一氧化碳和赤铁矿(主要成分是氧化铁)炼铁的化学方程式为 。
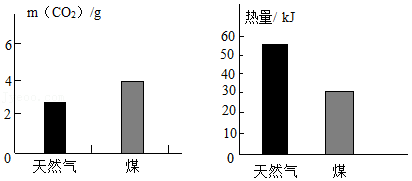
天然气广泛应用于生产生活,其主要成分是甲烷(CH4)。
Ⅰ.天然气是重要的能源
(1)天然气属于 (填“可再生”或”不可再生”)能源。
(2)室温下,充分燃烧1g天然气和1g煤,产生的CO2及热量的对比如图所示。据图分析,与煤相比,用天然气作燃料的优点有 。
(3)甲烷可直接应用于燃料电池,电池工作时的能量转化方式为 。
Ⅱ.天然气是重要的化工原料
(4)甲烷和二氧化碳在高温下催化重整(Ni作催化剂)可制得CO和H2。该反应的化学方程式为 。
(5)甲烷无氧催化重整可获得碳氢化合物X,X的相对分子质量为106,且碳、氢元素的质量比为48:5,则X的化学式为 。
阅读科普短文,回答相关问题。
钠元素在自然界中分布很广,储量极为丰富,常以氯化钠、碳酸钠、硫酸钠等物质存在。
19世纪初,英国化学家戴维在实验室中首次制得了金属钠。
钠是一种银白色金属,质软,密度为0.97g•cm﹣3,熔点为97.8℃。金属钠的性质很活泼,能与许多物质发生化学反应。钠暴露在空气中,与氧气反应生成氧化钠(Na2O),钠在空气中燃烧,生成淡黄色的过氧化钠(Na2O2);钠遇水立即发生剧烈反应,生成氢氧化钠和氢气。因此,实验室常将钠保存在煤油中。
金属钠的用途广泛。钠和钾形成的合金熔点低,常温下呈液态,可用作快中子反应堆的热交换剂。利用钠的强还原性,在一定条件下可以将钛(Ti)、锆(Zr)等稀有金属从其氯化物中置换出来。
工业上通常采用电解熔融氯化钠的方法制取单质钠。
(1)自然界中钠元素以 (填“单质”或“化合物”)形式存在。
(2)钠保存在煤油中,是为了防止钠与空气中的 反应而变质。
(3)过氧化钠中的阴离子为O22﹣,1个O22﹣离子含有的电子数为 。
(4)钠钾合金用作快中子反应堆的热交换剂,利用钠钾合金良好的 (填字母)。
a.导电性
b.导热性
c.延展性
(5)写出高温下钠与四氯化钛反应的化学方程式: 。