酸、碱、盐是重要的化合物,研究它们的性质有重要意义.
34Cl三种固体在水中的溶解度曲线如图所示,请仔细观察曲线,回答下列问题:
①三种固体物质的溶解度受温度影响最小的是 .
②30℃时三种固体物质饱和水溶液中溶质的质量分数由大到小的顺序是 .
3固体的质量为 g(保留一位小数).
223、稀硫酸四种溶液,它们只有编号却没有标签.某同学按下列步骤鉴别四种溶液.

①写出反应Ⅲ的化学方程式 .
②如图是水和NaOH水溶液中微粒的存在情况示意图,由此分析C溶液能使酚酞溶液变红的原因是 (填序号).

+32﹣数目
2﹣数目
2+数目
﹣+数目.

下列四个图象中,能正确反映对应变化关系的是( )
|
|
|
|
A.向一定量的氢氧化钠溶液中逐滴加入pH=2的稀盐酸至过量 |
B.某温度时,向一定量的饱和石灰水中加入少量生石灰 |
C.向盐酸和氯化镁的混合溶液中滴加氢氧化钠溶液 |
D.将水通电一段时间 |
A.AB.BC.CD.D
根据下表回答问题:
温度/℃ |
10 |
20 |
30 |
40 |
50 |
60 |
|
溶解度 /g |
NaCl |
35.8 |
36.0 |
36.3 |
36.6 |
37.0 |
37.3 |
4Cl |
33.5 |
37.2 |
41.4 |
45.8 |
50.4 |
55.2 |
|
(1)海水中含有大量的氯化钠,海水晒盐的原理是 ,氨碱法制纯碱先向饱和食盐水中通入氨气,通入氨气的作用是 3溶液中加入 以回收氨,使之循环使用。
(2)氯化钠和氯化铵具有相同溶解度的温度范围在 ℃之间。
4Cl溶液,经过如下操作后,得到固体。
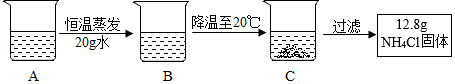
I.C中溶液的质量是 4Cl的 (选填“饱和”或“不饱和”)溶液,该溶液中溶质的质量分数为 (结果精确到0.1%)。
II.对以上过程的分析,正确的是 (选填编号)。
①A到B的过程中,溶质质量没有改变
②B中溶质与溶剂的质量比为55.2:100
4Cl固体的温度在40℃至50℃之间。
下列说法中,不正确的是( )
A.溶液中有晶体析出时,溶质质量减小,则溶质质量分数一定减小
B.将钢铁制成合金是有效减缓钢铁制品锈蚀的方法之一
C.碱溶液中都含有氢氧根离子,因此碱具有相似的化学性质
D.自然界中二氧化碳的循环平衡,对地球生命具有重要意义
我市东临渤海,有着丰富的海洋资源,请思考下列问题
(1)已知东营盐场测得:①海水中含NaCl约为3.5%;②在海边打深井,井水中含NaCl约为8%.晒盐最好用 (填序号)作原料。
(2)关于晒盐原理的说法正确的是 。
A、利用阳光和风力,使水分蒸发,析出盐
B、日光照晒后,氯化钠的溶解度变小
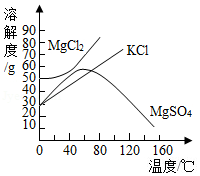
(3)海水晒盐提取食盐晶体后留下的母液叫卤水,其中含有的KCl、MgCl2、MgSO4等物质可作为重要的化工原料,它们的溶解度曲线如图所示。
①60℃时,将50g;硫酸镁加入到100g水中,充分搅拌,所得溶液的溶质质量分数为 ,若使其形成饱和溶液,可采取的措施有 。
A、增加溶质 B、蒸发溶剂 C、升高温度 D、降低温度
②对卤水中含有的KCl、MgCl2、MgSO4三种物质,下列说法正确的是 。
A、三种物质均为易溶物质
B、20℃时,向40gKCl固体和40gMgCl2固体中分别加入100g水充分溶解后,两种溶液均能达到饱和状态。
C、60℃时,三种物质溶于水形成的溶液浓度可能相等。
控制变量法是科学探究中常用的方法之一。
(1)在探究固体物质的溶解度时,需要考虑的因素有:①溶质的种类;②溶剂的种类;③溶质最多被溶解的质量;④溶剂的质量;⑤温度。
如测定“某物质在不同温度下的溶解度”,研究的是 (填序号)受温度的影响,这就需要控制其他因素保持不变。
(2)右表是利用控制变量法测得的氯化钠、硝酸钾在不同温度时的溶解度,请根据表格内容及实验现象回答下列问题。
温度(℃) |
20 |
40 |
50 |
|
溶解度/g |
NaCl |
36.0 |
36.6 |
37.0 |
KNO3 |
31.6 |
63.9 |
85.5 |
|
①从上表可知,两种物质的溶解度受温度变化影响较大的是 ;
②20℃时,将等质量的NaCl、KNO3分别放入盛有100g水的两个烧杯中,充分溶解后如图1所示,升温到50℃时如图2所示。试判断:50℃时甲烧杯中的溶液一定是 (填“饱和溶液”、“不饱和溶液”或“不能确定”)。

如图为A、B、C三种物质的溶解度曲线,试回答:
(1)t2℃时A、B、C三种物质的溶解度大小关系是 ;
(2)M点的含义是 ;
(3)t1℃时40gA物质加入到50g水充分断搅拌,形成溶液的溶质质量分数是 。
(4)将t2℃时A、B、C三种物质饱和溶液的温度降到t1℃时,三种溶液的溶质质量分数大小关系是 。

甲图是A、B、C三种固体物质的溶解度曲线。
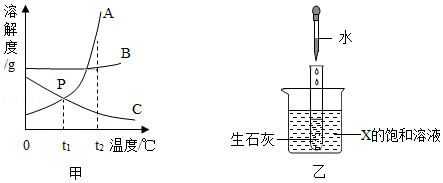
(1)甲图中,P点所表示的含义为 。
(2)t2℃时,在温度不变的情况下,将B物质的不饱和溶液转变成饱和溶液可采取的一种方法是 。
(3)将t2℃时A、B、C三种物质的饱和溶液降温到t1℃时,三种溶液的溶质质量分数由大到小的顺序是 。
(4)如乙图所示,20℃时,把试管放入盛有X的饱和溶液的烧杯中,在试管中加入一小块生石灰,再加入适量的水,烧杯中的溶液逐渐变浑浊,则X可能为 (填“A”或“B”或“C”)固体物质。
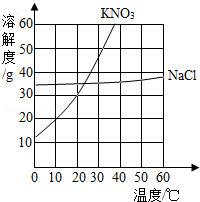
结合如图中KNO3和NaCl的溶解度曲线,回答下列问题。
(1)10℃时,溶解度较大的物质是 ;
(2)20℃时,将20gNaCl加入到100g水中,充分溶解后,得到 (填“饱和”或“不饱和”)溶液;
(3)将50℃的KNO3饱和溶液降温至10℃,下列分析正确的是 。
A.溶液中溶质质量不变
B.降温后的溶液仍是饱和溶液
C.溶液中溶质的质量分数变大
根据下表数据,回答下列问题。
温度/℃ |
10 |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
90 |
|
溶解度/g |
KCl |
31.0 |
34.0 |
37.0 |
40.0 |
42.6 |
45.5 |
48.3 |
51.1 |
54.0 |
KNO3 |
20.9 |
31.6 |
45.8 |
53.9 |
85.5 |
110 |
138 |
160 |
202 |
|
(1)KCl 和KNO3中,溶解度受温度影响较小的是 ;
(2)30℃时,KCl饱和溶液中,KCl和H2O的质量比为 ;
(3)将200g KNO 3和2g KCl的混合物,投入到100g 90℃的水中完全溶解,再降温至20℃,析出晶体的化学式为 。
分析处理图表中的信息是学习化学的一种重要方法,如表是NH 4Cl和KNO 3在不同温度时的溶解度数据:
| 温度/℃ |
10 |
30 |
50 |
70 |
|
| 溶解度/g |
NH 4Cl |
33.3 |
41.4 |
50.4 |
55.2 |
| KNO 3 |
20.9 |
45.8 |
85.5 |
110 |
|
根据上述数据,回答下列问题:
(1)从上表可知,50℃时,NH 4Cl的溶解度为 g.
(2)NH 4Cl和KNO 3的溶解度受温度影响比较大的物质是 (填化学式).
(3)欲配制质量分数为10%的KNO 3溶液,需要的玻璃仪器有烧杯、量筒、胶头滴管和 .
(4)烧杯中A中是60℃时,含有100g水的NH 4Cl不饱和溶液,经过如图1的变化过程
(在整个过程中,不考虑水分的蒸发),则C烧杯中溶液的质量为 g 
(5)某同学欲验证NH 4Cl固体溶于水时吸收热量,设计如图2实验,通过观察到 现象得以验证.
A.a端液面高于b端液面
B.a端液面低于b端液面.
已知KNO3的溶解度随温度的升高而增大。现将某温度下100克饱和KNO3溶液加热,则该溶液中溶质的质量会 。
根据图中A,B.C三种固体的溶解度曲线回答:
1℃时,A的不饱和溶液变成饱和溶液可采用的一种方法是 ;
2℃时,A,B,C三种物质的溶解度大小关系是 ;
21℃,不会析出晶体的是 。

分析处理图表信息是学习的一种重要方法,如表是氯化钠和硝酸钾在不同温度下的溶解度。
温度/℃ |
20 |
40 |
60 |
80 |
|
溶解度/g |
NaCl |
36.0 |
36.6 |
37.3 |
38.4 |
3 |
31.6 |
63.9 |
110 |
169 |
|
这两种固体物质在水中的溶解度曲线如图所示:
请仔细阅读图表后回到下列问题:
(1)A曲线表示的是 3”)
(2)P点的含义是 。
21℃,所得溶液的质量分数关系是A B.(填“<”、“>”或“=”)
