溶液对于自然界中的生命活动和人类生产活动具有重要的意义,多角度认识溶液有助于指导我们的生活。
(1)关于溶液的说法,正确的是 (填写标号)
A.溶液中各部分的性质相同B.均一、稳定的液体一定是溶液
C.浓溶液不一定是饱和溶液D.溶液加水稀释后溶质的质量变小
(2)表Ⅰ是部分物质在20℃时的溶解性;表Ⅱ是氯化钠、碳酸钠在不同温度时的溶解度。
离子 |
OH﹣ |
Cl﹣ |
CO32﹣ |
SO42﹣ |
K+ |
溶 |
溶 |
溶 |
溶 |
Mg2+ |
不 |
溶 |
微 |
溶 |
Ba2+ |
溶 |
溶 |
不 |
不 |
表Ⅰ空格中应填写 ;分析表Ⅱ可知,氯化钠和碳酸钠的饱和溶液溶质质量分数相同时的温度是 。
温度 (℃) |
0 |
10 |
20 |
30 |
40 |
氯化钠(g) |
35 |
35.5 |
36 |
36.5 |
37 |
碳酸钠(g) |
6 |
10 |
18 |
36.5 |
50 |
(3)简单解释“夏天晒盐、冬天捞碱”的科学原理 。
如图是a、b、c三种固体物质的溶解度曲线,下列说法正确的是( )

A.a属于易溶性物质
B.t℃时c物质的饱和溶液,可采用升高温度方法使其变为不饱和溶液
C.90℃时,将50ga物质加入到50g水中充分搅拌,可得到100ga的饱和溶液
D.将20℃时三种物质的饱和溶液升温到90℃,所得溶液中溶质的质量分数的大小关系是:a>c>b
M是硝酸钾或氯化铵中的一种。硝酸钾和氯化铵的溶解度曲线如图1所示。某化学兴趣小组用物质M进行了如图2所示实验。下列说法不正确的是( )

A.物质M是硝酸钾
B.溶液②中溶质质量分数为37.5%
C.溶液①②③中,溶质质量分数的关系是②>③>①
D.溶液①为不饱和溶液,溶液②和③为饱和溶液
硫酸锂(Li2SO4)和硝酸钾在不同温度时的溶解度如表:
温度/℃ |
0 |
10 |
20 |
30 |
40 |
|
溶解度/g |
Li2SO4 |
36.1 |
35.4 |
34.8 |
34.3 |
33.9 |
KNO3 |
13.3 |
20.9 |
31.6 |
45.8 |
63.9 |
|
请回答下列问题
(1)依据溶解度表,绘制溶解度曲线如图1所示,其中能表示Li2SO4溶解度曲线的是 乙 。(填“甲”或“乙”)
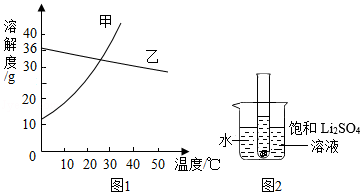
(2)Li2SO4和KNO3在某一温度时具有相同的溶解度x,则x的范围是 。
(3)40℃时,有含少量Li2SO4的KNO3饱和溶液,欲从中提纯KNO3晶体,方法是 。
(4)将10℃时两种物质的饱和溶液分别升温至30℃,所得Li2SO4溶液中溶质的质量分数 (填“>”、“<”或“=”)KNO3溶液中溶质的质量分数。
(5)如图2所示,20℃时,将盛有饱和Li2SO4溶液的试管放入盛水的烧杯中,向烧杯的水中加入某物质后,试管内有晶体析出。则加入的物质可以是 (填字母序号)。
①浓硫酸②冰块③生石灰固体④硝酸铵固体⑤氢氧化钠固体
A.②④B.①③⑤C.③④D.①②⑤
A、B两种物质的溶解度曲线如图所示,下列说法错误的是( )

A.在t2℃时A的溶解度大于B的溶解度
B.A、B两种物质的溶解度都随温度升高而增大
C.t1℃时,A、B两种物质的饱和溶液中,溶质质量分数相等
D.t2℃时,A的饱和溶液中溶质质量分数为30%
如图是甲、乙两种固体物质在水中的溶解度曲线。下列说法正确的是( )

A.t1℃时,甲、乙两种物质的饱和溶液中溶质的质量分数相等
B.由t2℃降温到t1℃,甲饱和溶液比乙饱和溶液析出晶体的质量多
C.t2℃时,将40g甲物质加入50g水中,充分溶解后溶液的质量为90g
D.t2℃时,用甲、乙配制等质量的饱和溶液,甲所需要水的质量比乙多
下表是氯化钠和碳酸钠在不同温度时的溶解度,根据此表回答:
| 温度(℃) |
10 |
20 |
30 |
40 |
|
| 溶解度(g) |
NaCl |
35.8 |
36.0 |
36.3 |
36.6 |
| Na 2CO 3 |
12.2 |
21.8 |
39.7 |
53.2 |
|
| |
|
|
|
|
|
(1)氯化钠与碳酸钠溶解度相等的温度范围是 ;40℃时,分别配制表中两种物质的饱和溶液,其中溶质质量分数较大的物质是 。
(2)写出一种将碳酸钠的不饱和溶液转化为饱和溶液的方法 。
(3)碳酸钠固体中混有少量的氯化钠,提纯碳酸钠的操作是:加水溶解→ → →过滤、洗涤、烘干。
(4)20℃时,取1.8g碳酸钠粉末加入试管中,先滴入几滴水,观察到粉末结块;再继续加入10mL水,振荡,用手触摸试管壁,感觉到发烫。下列有关说法正确的是 (填序号)。
a.滴入几滴水,粉末结块是由于生成了晶体(Na 2CO 3•10H 2O),该晶体属于混合物
b.碳酸钠溶于水时放热
c.加入10mL水,振荡,会观察到固体部分溶解
d.向所得的溶液中加入几滴酚酞试液,溶液呈红色
分别向50g FeSO4和CuSO4溶液中,加入一定质量Mg粉恰好完全反应。随Mg粉消耗,Mg粉与溶液中FeSO4、CuSO4的质量变化见图。请读取图象信息并结合金属活动性顺序分析,下面说法不合理的是( )

A.反应前,溶液中溶质质量分数:FeSO4<CuSO4
B.反应后,两溶液底部分别析出的金属是Fe和Cu
C.反应后,两溶液底部析出金属的质量:Fe<Cu
D.反应后,若FeSO4和CuSO4对应新溶液的溶质质量分数分别为A、B,则A>B
为探究物质溶解过程中的能量变化,某同学设计图Ⅰ所示装置。在盛有水的烧杯中放入一装有饱和硝酸钾溶液的试管,向水中加入足量物质X,搅拌。结合图Ⅱ硝酸钾溶解度曲线,对硝酸钾溶液变化的推断,合理的是( )
①X为NaCl固体,试管中无晶体析出,硝酸钾溶液仍是饱和溶液
②X为NaOH固体,试管中无晶体析出,硝酸钾溶液仍是饱和溶液
③X为NH4NO3晶体,试管中有晶体析出,硝酸钾溶液仍是饱和溶液
④X为浓H2SO4,试管中无晶体析出,硝酸钾溶液为不饱和溶液
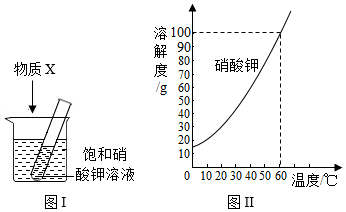
A.①②③B.①③④C.①②④D.②③④
)1926年,我国著名化学家侯德榜先生创立了侯氏制碱法,促进了世界制碱技术的发展,该技术以从海水中提取出来的食盐(NaCl)为主要原料制取纯碱,同时得到可用作化学肥料的物质氯化铵(NH 4Cl),NaCl和NH 4Cl的溶解度曲线如图2所示,请回答下列问题:

①根据图2所示,t 2℃时,NH 4Cl的溶解度是 g。
②通过NaCl的溶解度曲线,可判断出海水"晒盐"是用 的方法从海水中得到NaCl(填写"蒸发结晶""降温结晶"之一)
③t 1℃时,将不同质量的NH 4Cl饱和溶液和NaCl饱和溶液均升温至t 2℃,此时,NH 4Cl溶液的溶质质量分数 NaCl溶液的溶质质量分数(填写"大于"等于"小于""无法判断"之一)。
如图中图一为四种物质的溶解度曲线,在图二中分别向两支试管内滴加一定量的水后,X和Y的饱和溶液均变浑浊,则下列说法错误的是( )
A.10℃时,物质溶解度大小关系为:①>③>②>④
B.X为Ce2(SO4)3,Y不一定是NH4H2PO4
C.若NH4H2PO4中混有少量的NaCl杂质,可在较高温度配成饱和溶液,再降温结晶除去
D.20℃时,将40g NaCl加入到100g水中,所得溶液中溶质和溶剂的质量比是2:5
我国化学家侯德榜创立的侯氏制碱法为纯碱工业技术的发展做出了杰出的贡献。在制备纯碱的过程中涉及Na2CO3、NaCl、NH4Cl、NaHCO3等物质。请结合表格数据回答下列问题:
温度/℃ |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
|
溶解度/g |
Na2CO3 |
7 |
12.2 |
21.8 |
39.7 |
48.8 |
47.3 |
46.4 |
NH4Cl |
29.4 |
33.3 |
37.2 |
41.4 |
45.8 |
50.4 |
55.2 |
|
NaHCO3 |
6.9 |
8.2 |
9.6 |
11.1 |
12.7 |
14.5 |
16.4 |
|
(1)表中三种物质中,溶解性属于可溶的物质是 。
(2)在50℃时,向100g水中加入48gNa2CO3充分搅拌所得溶液质量为 ;保持烧杯中各物质质量不变,降温至40℃时,所得溶液溶质的质量分数会 (填“变小”、“不变”或“变大”)。
(3)请根据表格中数据,在如图中绘制出碳酸钠的溶解度曲线。

(4)根据溶解度曲线回答下列问题:
①60℃时,向等质量的上述四种固体物质中分别加水配成饱和溶液,所得溶液质量由大到小的顺序是 。
②侯氏制碱法的关键步骤是:先向饱和食盐水中通入氨气,制成饱和氨盐水,氨盐水吸收二氧化碳后生成碳酸氢钠和氯化铵,其化学方程式为NaCl+NH3+H2O+CO2=NH4Cl+NaHCO3.请问生成的碳酸氢钠和氯化铵,哪种物质首先析出,理由是 。
如图是A、B、C三种固体物质的溶解度曲线,请根据图示回答:
(1)t3℃时,将60gB物质加入到50g水中,充分搅拌后,所得溶液的质量是 g。
(2)图中P点所表示的B物质的溶液为 (填“饱和”或“不饱和”)溶液,欲将t1℃时C物质的不饱和溶液变为饱和溶液,可采用的方法是 (任写一种)。
(3)将t2℃时A、B、C三种物质的饱和溶液分别升温到t3℃(忽略水的蒸发),三种溶液的溶质质量分数由大到小的顺序是 。

如图是3种物质的溶解度曲线,下列叙述正确的是( )

4Cl的溶解度
23溶液的溶质度量分数为49%
23溶液由80℃冷却至40℃时,有固体析出
4Cl和NaCl固体溶于适量的水,恰好均配成饱和溶液,所得溶液的质量前者小于后者