[化学--选修3:物质结构与性质]
研究发现,在 低压合成甲醇反应 中, 氧化物负载的 氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。回答下列问题:
(1) 基态原子核外电子排布式为________。元素 与O中,第一电离能较大的是________,基态原子核外未成对电子数较多的是________。
(2) 和 分子中 原子的杂化形式分别为________和________。
(3)在 低压合成甲醇反应所涉及的4种物质中,沸点从高到低的顺序为________,原因是________。
(4)硝酸锰是制备上述反应催化剂的原料, 中的化学键除了 键外,还存在________。
(5) 具有 型结构(如图),其中阴离子采用面心立方最密堆积方式, 射线衍射实验测得 的晶胞参数为 ,则 为________ 。 也属于 型结构,晶胞参数为 ,则 为________ 。

【选修三:物质结构与性质】磷酸亚铁锂(
)可用作锂离子电池正极材料,具有热稳定性好、循环性能优良、安全性高等特点,文献报道可采用
、
、
和苯胺等作为原料制备。回答下列问题:
(1)在周期表中,与Li的化学性质最相似的邻族元素是________,该元素基态原子核外M层电子的自旋状态________(填"相同"或"相反")。
(2) 中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的 的结构式为________,其中Fe的配位数为________。
(3)苯胺  )的晶体类型是________。苯胺与甲苯(
)的晶体类型是________。苯胺与甲苯(  )的相对分子质量相近,但苯胺的熔点(-5.9℃)、沸点(184.4℃)分别高于甲苯的熔点(-95.0℃)、沸点(110.6℃),原因是________。
)的相对分子质量相近,但苯胺的熔点(-5.9℃)、沸点(184.4℃)分别高于甲苯的熔点(-95.0℃)、沸点(110.6℃),原因是________。
(4) 中,电负性最高的元素是________;P的________杂化轨道与O的2p轨道形成________键。
(5) 和 属于简单磷酸盐,而直链的多磷酸盐则是一种复杂磷酸盐,如:焦磷酸钠、三磷酸钠等。焦磷酸根离子、三磷酸根离子如下图所示:
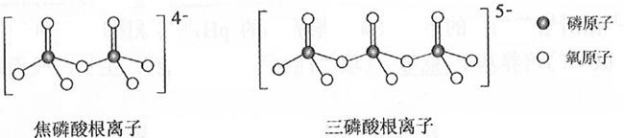
这类磷酸根离子的化学式可用通式表示为________(用 n代表P原子数)。
锌在工业中有重要作用,也是人体必需的微量元素。回答下列问题:
(1)Zn原子核外电子排布式为________。
(2)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成。第一电离能 ________ (填"大于"或"小于")。原因是________。
(3) 具有较高的熔点(872 ℃),其化学键类型是________; 不溶于有机溶剂而 、 、 能够溶于乙醇、乙醚等有机溶剂,原因是________。
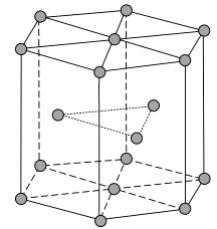
(4)《中华本草》等中医典籍中,记载了炉甘石( )入药,可用于治疗皮肤炎症或表面创伤。 中,阴离子空间构型为________,C原子的杂化形式为________。 (5)金属Zn晶体中的原子堆积方式如图所示,这种堆积方式称为________。六棱柱底边边长为 acm,高为 ccm,阿伏加德罗常数的值为 , Zn的密度为________ (列出计算式)。
硫及其化合物有许多用途,相关物质的物理常数如下表所示:
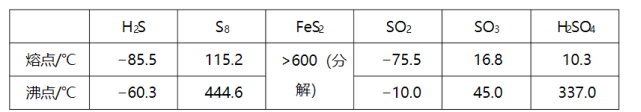
回答下列问题:
(1)基态Fe原子价层电子的电子排布图(轨道表达式)为________,基态S原子电子占据最高能级的电子云轮廓图为________ 形。
(2)根据价层电子对互斥理论, , , 的气态分子中,中心原子价层电子对数不同于其他分子的是________。
(3)图(a)为 的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为________。
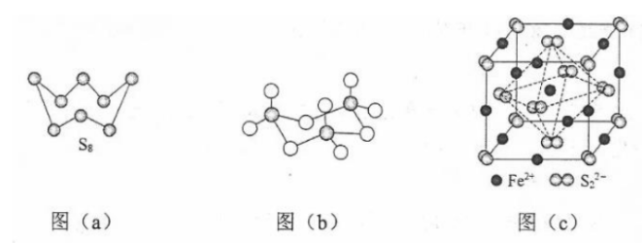
(4)气态三氧化硫以单分子形式存在,其分子的立体构型为________形,其中共价键的类型有________种;固体三氧化硫中存在如图(b)所示的三氯分子。该分子中S原子的杂化轨道类型为________。
(5) 晶体的晶胞如图(c)所示,晶胞边长为 , 相对式量为M、阿伏伽德罗常数的值为 , 其晶体密度的计算表达式为________ ;晶胞中 位于 所形成的正八面体的体心,该正八面体的边长为________ nm
Li是最轻的固体金属,采用Li作为负极材料的电池具有小而轻,能量密度大等优良性能,得到广泛应用,回答下列问题:
(1)下列Li原子电子排布图表示的状态中,能量最低和最高的分别为________、________。(填标号)
| A. |
|
| B. |
|
| C. |
|
| D. |
|
(2) 与 具有相同的电子构型, 小于 ,原因是________。
(3) 是有机合成中常用的还原剂, 中的阴离子空间构型是________。中心原子的杂化形式为________, 中,存在________(填标号)。
| A. |
离子键 |
| B. |
σ键 |
| C. |
π键 |
| D. |
氢键 |
(4) 是离子晶体,其晶格能可通过图(a)的 Born-Haber循环计算得到

可知,Li原子的第一电离能为________ , O=O键键能为________ , 晶格能为________
(5) 具有反莹石结构,晶胞如图(b)所示。已知晶胞参数为0.4665mm,阿伏加德罗常数的值为 ,则 的密度为 ________ (列出计算式)。
钾和碘的相关化合物在化工、医药、材料等领域有着广泛的应用.回答下列问题:
(1)元素K的焰色反应呈紫红色,其中紫色对应的辐射波长为nm(填标号).
| A. |
404.4 |
| B. |
553.5 |
| C. |
589.2 |
| D. |
670.8 |
| E. |
766.5 |
(2)基态K原子中,核外电子占据的最高能层的符号是________,占据该能层电子的电子云轮廓图形状为________.K和Cr属于同一周期,且核外最外层电子构型相同,但金属K的熔点、沸点等都比金属Cr低,原因是________.
(3)X射线衍射测定等发现, 中存在 离子. 离子的几何构型为________,中心原子的杂化类型为________.
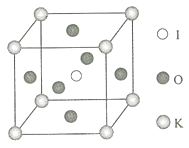
(4) 晶体是一种性能良好的非线性光学材料,具有钙钛矿型的立体结构,边长为 ,晶胞中K、I、O分别处于顶角、体心、面心位置,如图所示.K与O间的最短距离为________nm,与K紧邻的O个数为________.
(5)在KIO 3晶胞结构的另一种表示中,I处于各顶角位置,则K处于________位置,O处于________位置.
砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等.回答下列问题:
(1)写出基态As原子的核外电子排布式________.
(2)根据元素周期律,原子半径Ga________As,第一电离能Ga________As.(填"大于"或"小于")
(3) 分子的立体构型为________,其中As的杂化轨道类型为________.
(4) 的熔点高于1000℃, 的熔点为77.9℃,其原因是________.
(5)GaAs的熔点为1238℃,密度为 , 其晶胞结构如图所示.
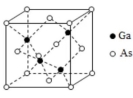
该晶体的类型为________,Ga与As以________键键合.Ga和As的摩尔质量分别为 和 , 原子半径分别为 和 ,阿伏伽德罗常数值为 ,则GaAs晶胞中原子的体积占晶胞体积的百分率为________.
[化学--选修3:物质结构与性质]
在普通铝中加入少量 和 后,形成一种称为拉维斯相的 微小晶粒,其分散在 中可使得铝材的硬度增加、延展性减小,形成所谓"坚铝",是制造飞机的主要村料。回答下列问题:
(1)下列状态的镁中,电离最外层一个电子所需能量最大的是(填标号)。
A. B. C. D.
(2)乙二胺 是一种有机化合物,分子中氮、碳的杂化类型分别是 、 。乙二胺能与Mg2+、Cu2+等金属离子形成稳定环状离子,其原因是,其中与乙二胺形成的化合物稳定性相对较高的是(填" "或" ")。
(3)一些氧化物的熔点如下表所示:
|
氧化物 |
|
|
|
|
|
熔点/°C |
|
|
|
|
解释表中氧化物之间熔点差异的原因 。
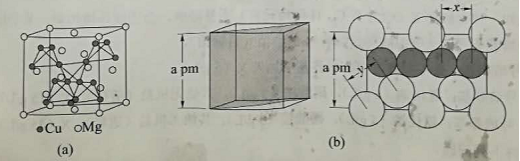
(4)图(a)是 的拉维斯结构, 以金刚石方式堆积,八面体空隙和半数的四面体空隙中,填入以四面体方式排列的 。图(b)是沿立方格子对角面取得的截图。可见, 原子之间最短距离 , 原子之间最短距离 。设阿伏加德罗常数的值为 ,则 的密度是 (列出计算表达式)。
[化学一一选修3: 物质结构与性质]
锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛。回答下列问题:
(1) 基态 Ge 原子的核外电子排布式为[Ar] ,有 个末成对电子。
(2) Ge 与 C 是同族元素, 原子之间可以形成双键、叁键, 但 原子之间难以形成双键或 叁键。从原子结构角度分析,原因是 。
(3)比较下列锗卤化物的熔点和沸点, 分析其变化规律及原因 。
|
|
|
|
|
|
熔点/ |
|
26 |
146 |
|
沸点/ |
|
186 |
约 400 |
(4) 光催化还原 制备 反应中,带状纳米 是该反应的良好催化剂。 、Ge、O 电负性由大至小的顺序是 。
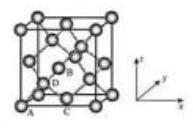
(5) Ge 单晶具有金刚石型结构, 其中 原子的杂化方式为_ , 微粒之间存在的作用力是_ 。
(6)晶胞有两个基本要素:
①原子坐标参数, 表示晶胞内部各原子的相对位置, 下图为 Ge 单晶的晶胞, 其中原子坐标参数 为 为 为 。则 原子的坐标参数为 。
②晶胞参数, 描述晶胞的大小和形状,已知 Ge 单晶的晶胞参数 , 其密度为 (列出计算式即可)。
过渡金属元素铬 是不锈钢的重要成分,在工农业生产和国防建设中有着广泛应用。回答下列问题:
(1)对于基态 原子,下列叙述正确的是 (填标号)。
A.轨道处于半充满时体系总能量低,核外电子排布应为
B. 电子能量较高,总是在比 电子离核更远的地方运动
C.电负性比钾高,原子对键合电子的吸引力比钾大
(2)三价铬离子能形成多种配位化合物。 中提供电子对形成配位键的原子是 ,中心离子的配位数为 。
(3) 中配体分子 、 以及分子 的空间结构和相应的键角如图所示。
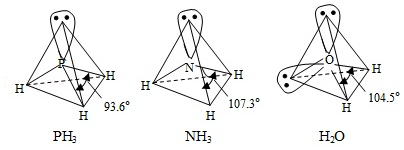
中 的杂化类型是 。 的沸点比 的 ,原因是 。 的键角小于 的,分析原因 。
(4)在金属材料中添加 颗粒,可以增强材料的耐腐蚀性、硬度和机械性能。 具有体心四方结构,如图所示。处于顶角位置的是 原子。设 和 原子半径分别为 和 ,则金属原子空间占有率为 %(列出计算表达式)。

我国科学家研发的全球首套千吨级太阳能燃料合成项目被形象地称为"液态阳光"计划。该项目通过太阳能发电电解水制氢,再采用高选择性催化剂将二氧化碳加氢合成甲醇。回答下列问题:
(1)太阳能电池板主要材料为单晶硅或多晶硅。Si的价电子层的电子排布式为______;单晶硅的晶体类型为_______。SiCl 4是生产高纯硅的前驱体,其中Si采取的杂化类型为______。SiCl 4可发生水解反应,机理如下:
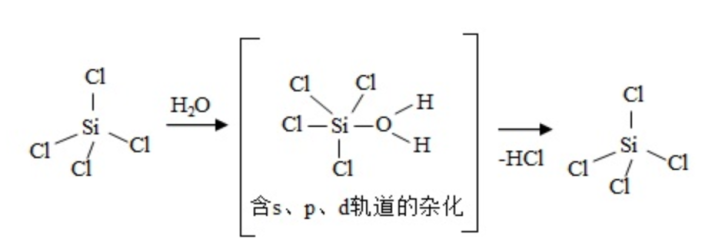
含s、p、d轨道的杂化类型有:①dsp 2、②sp 3d、③sp 3d 2,中间体SiCl 4(H 2O)中Si采取的杂化类型为_______ (填标号)。
(2)CO 2分子中存在________个σ键和________个π键。
(3)甲醇的沸点(64.7℃)介于水(100℃)和甲硫醇(CH 3SH,7.6℃)之间,其原因是_____________。
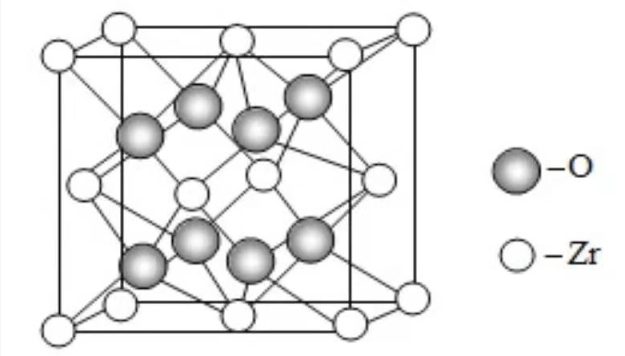
(4)我国科学家发明了高选择性的二氧化碳加氢合成甲醇的催化剂,其组成为ZnO/ZrO 2固溶体。四方ZrO 2晶胞如图所示。Zr 4+离子在晶胞中的配位数是____________,晶胞参数为 apm、 apm、 cpm,该晶体密度为____________g·cm -3(写出表达式)。在ZrO 2中掺杂少量ZrO后形成的催化剂,化学式可表示为Zn xZr 1- xO y,则 y=____________(用 x表达)。
CdSnAs2是一种高迁移率的新型热电材料,回答下列问题:
(1)Sn为ⅣA族元素,单质Sn与干燥Cl2反应生成SnCl4.常温常压下SnCl4为无色液体,SnCl4空间构型为 ,其固体的晶体类型为 。
(2)NH3、PH3、AsH3的沸点由高到低的顺序为 ( 填化学式,下同),还原性由强到弱的顺序为 ,键角由大到小的顺序为 。
(3)含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。一种Cd2+配合物的结构如图所示,1mol该配合物中通过螯合作用形成的配位键有 mol,该螯合物中N的杂化方式有 种。
(4)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标。四方晶系CdSnAs2的晶胞结构如图所示,晶胞棱边夹角均为90°,晶胞中部分原子的分数坐标如下表所示。
|
坐标 原子 |
x |
y |
z |
|
Cd |
0 |
0 |
0 |
|
Sn |
0 |
0 |
0.5 |
|
As |
0.25 |
0.25 |
0.125 |
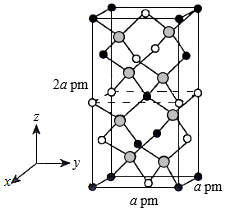
一个晶胞中有 个Sn,找出距离Cd(0,0,0)最近的Sn ( 用分数坐标表示)。CdSnAs2晶体中与单个Sn键合的As有 个。
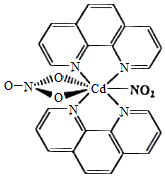
α﹣氰基丙烯酸异丁酯可用作医用胶,其结构简式如图。下列关于α﹣氰基丙烯酸异丁酯的说法错误的是( )
A.其分子式为C8H11NO2
B.分子中的碳原子有3种杂化方式
C.分子中可能共平面的碳原子最多为6个
D.其任一含苯环的同分异构体中至少有4种不同化学环境的氢原子
B3N3H6(无机苯)的结构与苯类似,也有大π键。下列关于B3N3H6的说法错误的是( )
A.其熔点主要取决于所含化学键的键能
B.形成大π键的电子全部由N提供
C.分子中B和N的杂化方式相同
D.分子中所有原子共平面