【选修三:物质结构与性质】
近年来我国科学家发现了一系列意义重大的铁系超导材料,其中一类为Fe−Sm−As−F−O组成的化合物。回答下列问题:
(1)元素As与N同族。预测As的氢化物分子的立体结构为________,其沸点比NH 3的________(填"高"或"低"),其判断理由是________。
(2)Fe成为阳离子时首先失去________轨道电子,Sm的价层电子排布式为4f 66s 2 , Sm 3+的价层电子排布式为________。
(3)比较离子半径:F −________O 2−(填"大于"等于"或"小于")。
(4)一种四方结构的超导化合物的晶胞结构如图1所示,晶胞中Sm和As原子的投影位置如图2所示。
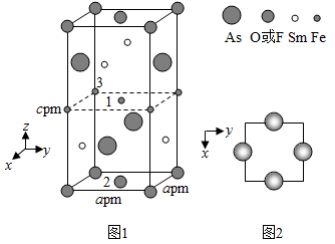
图中F −和O 2−共同占据晶胞的上下底面位置,若两者的比例依次用 x和1− x代表,则该化合物的化学式表示为________,通过测定密度 ρ和晶胞参数,可以计算该物质的 x值,完成它们关系表达式: ρ=________g·cm −3。
以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图1中原子1的坐标为( , , ),则原子2和3的坐标分别为________、________。
锌在工业中有重要作用,也是人体必需的微量元素。回答下列问题:
(1)Zn原子核外电子排布式为________。
(2)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成。第一电离能 ________ (填"大于"或"小于")。原因是________。
(3) 具有较高的熔点(872 ℃),其化学键类型是________; 不溶于有机溶剂而 、 、 能够溶于乙醇、乙醚等有机溶剂,原因是________。
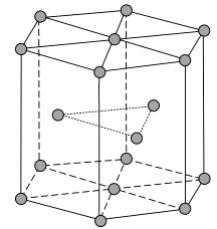
(4)《中华本草》等中医典籍中,记载了炉甘石( )入药,可用于治疗皮肤炎症或表面创伤。 中,阴离子空间构型为________,C原子的杂化形式为________。 (5)金属Zn晶体中的原子堆积方式如图所示,这种堆积方式称为________。六棱柱底边边长为 acm,高为 ccm,阿伏加德罗常数的值为 , Zn的密度为________ (列出计算式)。
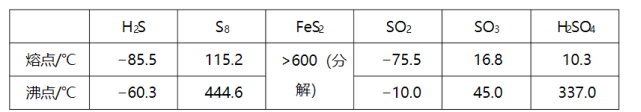
硫及其化合物有许多用途,相关物质的物理常数如下表所示:
回答下列问题:
(1)基态Fe原子价层电子的电子排布图(轨道表达式)为________,基态S原子电子占据最高能级的电子云轮廓图为________ 形。
(2)根据价层电子对互斥理论, , , 的气态分子中,中心原子价层电子对数不同于其他分子的是________。
(3)图(a)为 的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为________。
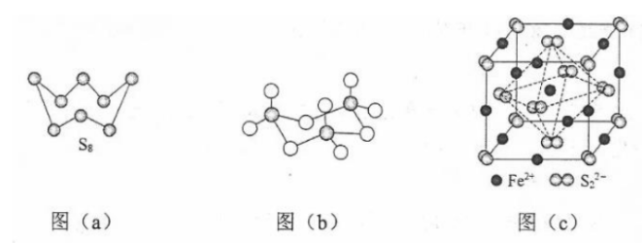
(4)气态三氧化硫以单分子形式存在,其分子的立体构型为________形,其中共价键的类型有________种;固体三氧化硫中存在如图(b)所示的三氯分子。该分子中S原子的杂化轨道类型为________。
(5) 晶体的晶胞如图(c)所示,晶胞边长为 , 相对式量为M、阿伏伽德罗常数的值为 , 其晶体密度的计算表达式为________ ;晶胞中 位于 所形成的正八面体的体心,该正八面体的边长为________ nm
Li是最轻的固体金属,采用Li作为负极材料的电池具有小而轻,能量密度大等优良性能,得到广泛应用,回答下列问题:
(1)下列Li原子电子排布图表示的状态中,能量最低和最高的分别为________、________。(填标号)
| A. |
|
| B. |
|
| C. |
|
| D. |
|
(2) 与 具有相同的电子构型, 小于 ,原因是________。
(3) 是有机合成中常用的还原剂, 中的阴离子空间构型是________。中心原子的杂化形式为________, 中,存在________(填标号)。
| A. |
离子键 |
| B. |
σ键 |
| C. |
π键 |
| D. |
氢键 |
(4) 是离子晶体,其晶格能可通过图(a)的 Born-Haber循环计算得到

可知,Li原子的第一电离能为________ , O=O键键能为________ , 晶格能为________
(5) 具有反莹石结构,晶胞如图(b)所示。已知晶胞参数为0.4665mm,阿伏加德罗常数的值为 ,则 的密度为 ________ (列出计算式)。
钾和碘的相关化合物在化工、医药、材料等领域有着广泛的应用.回答下列问题:
(1)元素K的焰色反应呈紫红色,其中紫色对应的辐射波长为nm(填标号).
| A. |
404.4 |
| B. |
553.5 |
| C. |
589.2 |
| D. |
670.8 |
| E. |
766.5 |
(2)基态K原子中,核外电子占据的最高能层的符号是________,占据该能层电子的电子云轮廓图形状为________.K和Cr属于同一周期,且核外最外层电子构型相同,但金属K的熔点、沸点等都比金属Cr低,原因是________.
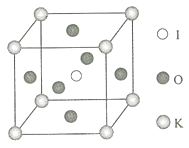
(3)X射线衍射测定等发现, 中存在 离子. 离子的几何构型为________,中心原子的杂化类型为________.
(4) 晶体是一种性能良好的非线性光学材料,具有钙钛矿型的立体结构,边长为 ,晶胞中K、I、O分别处于顶角、体心、面心位置,如图所示.K与O间的最短距离为________nm,与K紧邻的O个数为________.
(5)在KIO 3晶胞结构的另一种表示中,I处于各顶角位置,则K处于________位置,O处于________位置.
东晋《华阳国志•南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品.回答下列问题:
(1)镍元素基态原子的电子排布式为________,3d能级上的未成对电子数为________.
(2)硫酸镍溶于氨水形成[Ni(NH 3) 6]SO 4蓝色溶液.
①[Ni(NH 3) 6]SO 4中阴离子的立体构型是________.
②在[Ni(NH 3) 6]SO 4中Ni 2+与NH 3之间形成的化学键称为________,提供孤电子对的成键原子是________.
③氨的沸点________(填"高于"或"低于")膦(PH 3),原因是________;氨是________分子(填"极性"或"非极性"),中心原子的轨道杂化类型为________.
(3)单质铜及镍都是由________键形成的晶体;元素铜与镍的第二电离能分别为:I Cu=1 958kJ•mol ﹣ 1、I Ni=1 753kJ•mol ﹣ 1,I Cu>I Ni的原因是________.
(4)某镍白铜合金的立方晶胞结构如图所示
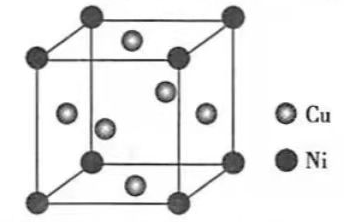
①晶胞中铜原子与镍原子的数量比为________.
②若合金的密度为d g•cm ﹣ 3,晶胞参数a=________nm.
砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等.回答下列问题:
(1)写出基态As原子的核外电子排布式________.
(2)根据元素周期律,原子半径Ga________As,第一电离能Ga________As.(填"大于"或"小于")
(3) 分子的立体构型为________,其中As的杂化轨道类型为________.
(4) 的熔点高于1000℃, 的熔点为77.9℃,其原因是________.
(5)GaAs的熔点为1238℃,密度为 , 其晶胞结构如图所示.
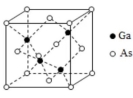
该晶体的类型为________,Ga与As以________键键合.Ga和As的摩尔质量分别为 和 , 原子半径分别为 和 ,阿伏伽德罗常数值为 ,则GaAs晶胞中原子的体积占晶胞体积的百分率为________.
CdSnAs2是一种高迁移率的新型热电材料,回答下列问题:
(1)Sn为ⅣA族元素,单质Sn与干燥Cl2反应生成SnCl4.常温常压下SnCl4为无色液体,SnCl4空间构型为 ,其固体的晶体类型为 。
(2)NH3、PH3、AsH3的沸点由高到低的顺序为 ( 填化学式,下同),还原性由强到弱的顺序为 ,键角由大到小的顺序为 。
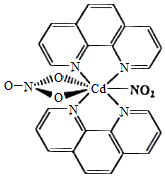
(3)含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。一种Cd2+配合物的结构如图所示,1mol该配合物中通过螯合作用形成的配位键有 mol,该螯合物中N的杂化方式有 种。
(4)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标。四方晶系CdSnAs2的晶胞结构如图所示,晶胞棱边夹角均为90°,晶胞中部分原子的分数坐标如下表所示。
|
坐标 原子 |
x |
y |
z |
|
Cd |
0 |
0 |
0 |
|
Sn |
0 |
0 |
0.5 |
|
As |
0.25 |
0.25 |
0.125 |
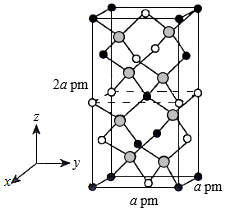
一个晶胞中有 个Sn,找出距离Cd(0,0,0)最近的Sn ( 用分数坐标表示)。CdSnAs2晶体中与单个Sn键合的As有 个。