如图1是a、b、c三种物质的溶解度曲线,回答下列问题:

①t 2℃时,a、b、c三种物质的溶解度由大到小的顺序为 .
②P点的含义是 .
③t 2℃时,将40ga物质加入50g水中,充分溶解后得到溶液的质量为 g.
④将a、b、c三种物质的饱和溶液从t 2℃降温到t 1℃时,溶液中溶质的质量分数不变的是 .
(2)A﹣G是初中化学常见物质,A、C在常温下是气体且元素组成相同,B是铁锈的主要成分,E的相对分子质量为100,它们的相互转化关系如图2(部分反应物、生成物及反应条件已略去),请回答下列问题:
①写出物质E的化学式 .
②写出有关反应的化学方程式:
(Ⅰ)A+B→ ;
(Ⅱ)G+Na 2CO 3溶液→ .
③写出F的一种用途 .
某化学小组从理论上初步探究“已知质量比的硝酸钾和氯化钠的混合物中提纯硝酸钾”。
【分析提纯方法】
表一:常温下(20℃)溶解度和溶解性的关系
溶解度S |
S≥10g |
1g≤S<10g |
0.01g≤S<1g |
S<0.01g |
溶解性 |
易溶 |
可溶 |
微溶 |
难溶 |
表二:硝酸钾和氯化钠在不同温度时的溶解度
温度/℃ |
0 |
20 |
40 |
60 |
80 |
100 |
|
溶解度/g |
3 |
13.3 |
31.6 |
63.9 |
110 |
169 |
246 |
NaCl |
35.7 |
36.0 |
36.6 |
37.3 |
38.4 |
39.8 |
|
3和NaCl的溶解性均为 。
3的溶解度曲线。
33在70℃时的溶解度约为 g。
【设计提纯步骤】
3和5gNaCl的混合物)
3﹣1)
(3)降温至20℃
(4)得到晶体
【设计提纯方案】
3,该小组同学结合已有知识,从理论上初步设计了以下方案;(不考虑不同溶质对溶解度的相互影响及实验过程中水和固体的损失等影响因素)
方案一 通过化学实验进行检验,取少量(4)中得到的晶体于试管中,加水配成溶液,滴加 ,观察实验现象。
3晶体的质量约为 g(精确到0.1g)与(4)中得到晶体的质量进行比较
方案三 与95%进行比较。
方案四 。

化学变化的本质特征是有新物质生成,化学变化中的一些现象有助于我们判断物质是否发生了化学变化,
分析一:化学变化中的现象
实验内容 |
实验现象 |
实验分析 |
(1) 木炭在氧气中燃烧 |
发出白光,发出热量 |
燃烧是 的剧烈的化学反应 |
(2) |
镁表面 铜无明显变化 |
镁与稀盐酸反应,铜不与稀盐酸反应 |
(3) |
产生白色沉淀 |
该反应的化学方程式
|
(4) |
玻璃管内的固体由红棕色变为 色 |
发生了化学变化 |
22444244的混合溶液)结合已有知识,进行大胆猜想:
(1)现象及可能产生该现象的依据
(2)现象及可能产生该现象的依据 。
根据表中信息,请回答下列问题。
测试类别 S化合价 |
氢化物 |
单质 |
① |
酸 |
盐 |
+6 |
﹣ |
﹣ |
3 |
24 |
2444424 |
② |
﹣ |
﹣ |
2 |
23 |
23 |
0 |
﹣ |
S |
﹣ |
||
﹣2 |
2S |
﹣ |
﹣ |
2S |
2S |
(1)填写表中内容:① ;② 。
(2)物质可以按照一定规律发生转化,请按要求各写出一个对应的化学方程式。
①置换反应 ;②复分解反应 。
424是农业上常用的铵态氮肥,在实验室检验其为铵态氮肥的实验操作是______(写出一种即可)
222O,反应前后硫元素化合价发生的变化是
(5)在实验室中,可用热的碱液除去试管内壁上附着的硫,请完成该反应的化学方程式: S+ NaOH═ 23+ + 2O。
有一包白色固体可能含氯化钠、碳酸钙、硝酸铵、氯化钡和硫酸钠中的一种或几种,实验小组设计如下实验方案,检验白色固体的成分(假设实验中每一步均恰好完全反应)。
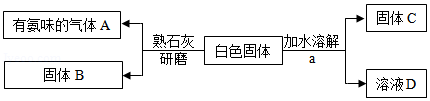
回答下列问题:
(1)a处的操作是 。
(2)气体A的化学式是 。
(3)硝酸铵在农业上常用作 肥。
(4)若固体C中加入稀硝酸,有一部分溶解则原粉末的成分中一定有 。
(5)若固体C中加入稀硝酸,固体不溶解,写出生成固体C的化学反应方程式 ,化学反应基本类型为 。
金属材料与人类的生产、生活密切相关。
(1)大自然向人类提供了丰富的金属矿物资源,其中提取量最大的是铁。工业上利用赤铁矿石炼铁的原理是 (用化学方程式表示)。实验室用的铁架台是铁的合金制成,合金比纯的金属硬度、强度更高, 也更好。用久的铁架台有一些出现锈迹,学校要对这些铁架台进行除锈,防锈处理,写出除去铁锈所发生的化学反应方程式 ,从实际考虑,学校应对这些除锈后的铁架台做 的防锈处理。
(2)为了比较铜、锌、铁三种金属的活动性强弱,可以将打磨光亮的两根铁丝分别插入 的溶液中,能判断出三种金属的活动性由强到弱的顺序是 。
随着人们生活水平的提高,汽车已经走进千家万户.
(1)在汽车电路中,经常用铜做导线,这是利用铜的延展性和 性.
(2)车体多用钢材制造,钢铁厂用赤铁矿为原料炼铁的原理是(用化学方程式表示) .
(3)为减少汽油燃烧产生的废气对环境的污染,我国开发推广使用一种车用乙醇汽油,其中含乙醇10%.请写出乙醇在空气中完全燃烧的化学方程式 .
对知识的归纳和总结是学习好化学的重要方法。在学习了碱的性质后,小红同学总结了氢氧化钙的四条化学性质(如图所示),即氢氧化钙与图中四类物质能够发生化学反应。
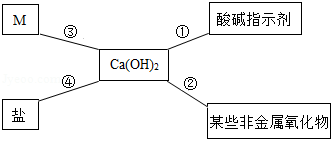
(1)图中M所属的物质类别是 。
(2)氢氧化钙可由生石灰和水反应制得,该放应能 (填"吸收"或"放出")热量。
(3)利用图中氢氧化钙能与 反应的性质,可以解释"用石灰浆粉刷墙壁,干燥后墙壁就变硬了"的现象。
(4)利用图中④氢氧化钙和盐反应的性质,除去氢氧化钠溶液中少量的氢氧化钙杂质。请写出该反应的化学方程式 。
金属材料是重要的资源,在日常生活中已经得到越来越广泛的应用。
(1)将铝片和硬铝片相互刻画,铝片上留下明显的划痕,说明 。
(2)沙漠地区的铁制品锈蚀较慢,其原因是 。
(3)为了比较铁、铜、银三种金属的活动性顺序强弱,某同学设计了下列四种方案:
①将铁丝、银丝分别浸入硫酸铜溶液中;②将银丝分别浸入到硫酸亚铁、硫酸铜溶液中;
③将铜丝、银丝分别浸入到硫酸亚铁溶液中;④将铜丝分别浸入到硫酸亚铁、硝酸银溶液中其中可行的方案是 (填序号)。可行方案中发生的基本反应类型为 。
(4)工业上将赤铁矿石冶炼成铁是一个复杂的过程。炼铁高炉中发生的主要反应有:
①高温下一氧化碳将铁矿石还原为铁;②高温煅烧石灰石;③灼热的焦炭和二氧化碳的反应;④焦炭充分燃烧,其中体现焦炭作用的反应是 (填序号)。
通过一年的化学学习,我们学会了从微观角度认识物质。
(1)如图是部分原子的结构示意图请回答问题:
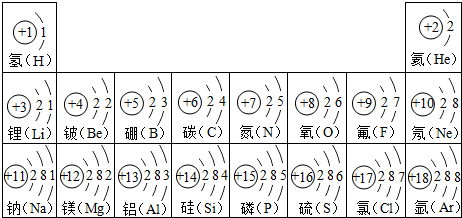
①化学上将质子数为 的所有氯原子统称为氯元素。
②8号元素和地壳中含量最多的金属元素组成的化合物中,金属元素的化合价为 。
③在化学反应中,11号元素的原子易 电子。
(2)如图是氢气在氯气中燃烧生成氯化氢的微粒示意图。
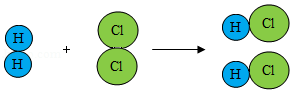
请据图回答:
①氢气可压缩储存于钢瓶中,因为受压时氢气分子之间的 减小。
②从微观的角度解释该化学变化的实质是 。
请你铵要求回答下列问题:
(1)阜新"宝地斯帕温泉"远近闻名。若要检验温泉水是硬水还是软水,可加入 检验。
(2)电解水的实验证明了水的组成。电解水的化学方程式为 。
(3)在做"细铁丝在盛有氧气的集气瓶中燃烧"的实验时,常常要在集气瓶里预先加少量的水,这样做的目的是 。
(4)为了设计实验证明二氧化碳能溶于水,某同学做了如图所示实验,该实验的现象是 。
(5)某纯净物X在空气中完全燃烧,反应的化学方程式为:X+2O 2  CO 2+2H 2O,则X的化学式为 。
CO 2+2H 2O,则X的化学式为 。
(6)氯化钠是食盐的主要成分,氯化钠的用途很多。例如,生活中的氯化钠是常用的调味品。此外,还可以利用氯化钠 等。

一班的同学在探究金属镁的化学性质时发现,将镁条放到盛有冷水的试管中,没有明显的现象,然后将试管放在酒精灯上加热,发现试管中有气泡产生。
(1)小明认为,据此现象可断定加热时镁能和水反应,小强认为小明的结论不正确,理由是 。
(2)小明向加热的试管中滴入酚酞溶液,溶液显红色,证明镁在加热时 (填“能”或“不能”)与水发生反应
(3)小明将加热后的试管放置在空气中一段时间后,同学们发现溶液中的红色消失了。
在确定酚酞溶液没有变质的情况下,请你根据初中所学化学知识,对溶液中红色消失的原因做出合理猜想。
猜想一:
猜想二:
请设计实验方案,对其中一种猜想进行验证 。(只需答出实验方案,不需要回答现象和结论)
海洋中有丰富的水生生物和化学资源。海水晒盐能得到粗盐和苦卤,粗盐中含有多种可溶性杂质(氯化镁、氯化钙等)和不溶性杂质(泥沙等)。请回答下列问题。
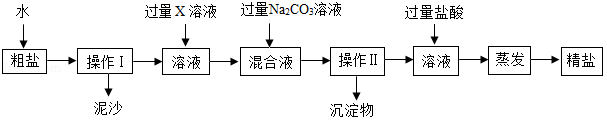
(1)蒸发过程中使用到玻璃棒,其作用是 。
(2)若要去除粗盐中可溶性的杂质氯化镁和氯化钙,可依次加入过量的X和碳酸钠两种溶液。下列物质中,可作为X的物质有 。
A、KOH
B、Ba(OH) 2
C、Ca(OH) 2
D、NaOH
(3)操作Ⅱ后向所得滤液中加入适量的盐酸,其目的是 ,最后通过蒸发结晶得到较为纯净的氯化钠。
根据如图图示回答下列问题:
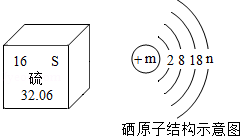
①从图中不能直接获取的信息是 。
A.硫属于非金属元素 B.硫的核外电子数为16
C.硫的相对原子质量为32.06 D.硫元素形成的单质有还原性
②根据硫原子的最外层电子数,推出硫元素的最低化合价为﹣2价,则硫元素的最高化合价为 价。
③元素周期表中同一主族的元素具有相似的化学性质,例如硒(Se)和S有相似的化学性质,则图中m= 。
初中阶段:物质得氧和失氧的反应是氧化还原反应;高中阶段:凡是有元素化合价升降的化学反应都是氧化还原反应.元素化合价升高的为还原剂,发生氧化反应;元素化合价降低的为氧化剂,发生还原反应;氧化反应和还原反应同时发生的,这样的反应称为氧化还原反应.请回答下列问题:
(1)根据化合价改变判断下列四种基本反应类型,一定不是氧化还原反应的是 .(选填序号)
A.化合反应 B.分解反应 C.置换反应 D.复分解反应
(2)下列化学反应中,属于氧化还原反应的是 (选填序号),该反应的还原剂是 (填化学式).
| A. |
Na 2CO 3+CaCl 2═CaCO 3↓+2NaCl |
B. |
Fe+CuSO 4═Cu+FeSO 4 |
| C. |
Ca(HCO 3) 2 |
D. |
CaO+H 2O═Ca(OH) 2 |
(3)下列反应中,氧化反应与还原反应在同一元素中进行的是 .(多选,选填字母序号)
| A. |
Cl 2+2NaOH═NaCl+NaClO+H 2O |
B. |
4P+5O 2 |
| C. |
Zn+CuCl 2═Cu+ZnCl 2 |
D. |
3NO 2+H 2O═2HNO 3+NO. |