有一种纳米材料添加剂,由铝粉、氧化铝粉末、铜粉中的一种或几种组成,为探究该添加剂的成分,化学学习小组进行了下列实验,请回答实验中的相关问题:
(1)取适量添加剂于试管中,加入足量稀盐酸,有红色固体残留并产生大量气泡,该现象说明添加剂中一定含有 。
(2)另取适量添加剂于另一试管中,加入一定量的硝酸银溶液,充分反应,过滤,得到滤渣和蓝色溶液。则生成蓝色溶液的化学方程式为 。蓝色溶液中一定含有的两种溶质是 。
(3)取(2)中的滤渣于试管中, ,说明该添加剂中含有氧化铝粉末。
请根据如图回答相关问题
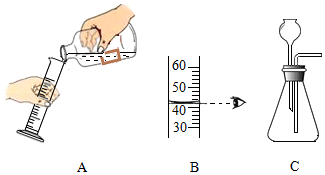
(1)A中倾倒液体的操作是:取下瓶塞,倒放在桌面上,标签朝向手心,量筒稍倾斜,量筒口与 ,缓缓地向量筒中倒入液体;B中液体的体积是 mL。
(2)①小萌欲用如图C装置制气体,发现该装置中存在 处错误,小萌纠正了其中的错误,并采用向下排空气法,制取了氢气,实验室制取氢气的化学方程式为 。
②小萌又选用了不同的化学药品,用纠正错误后的C装置制得了另一种气体,该气体需用向上排空气法收集,则实验室制取该气体的化学方程式为 。
③为确定气体发生装置,应考虑反应条件和 。
松花皮蛋是黄石八珍之一。腌制皮置的一种原料是由NaCl、CaO和Na 2CO 3组成的固体混合物。某化学兴趣小组用该原料,在实验室进行如下实验:将该固体混合物放入烧杯中,加入足量的蒸馏水。充分溶解后过滤,得到白色沉淀和无色澄清滤液。同学们对滤液的溶质成分进行了探究。
请完成以下探究过程,并将①~⑤处答案填入答题卡相应位置。
固体溶解过程中发生了两个化学反应:CaO+H 2O=Ca(OH) 2 。
【提出问题】滤液中的溶质成分是什么?
【作出猜想】Ⅰ.溶质为:NaCl、NaOH、Ca(OH) 2;
Ⅱ.溶质为:NaCl、NaOH;
Ⅲ.溶质为: 。
【设计方案】
| 实验操作 |
现象 |
结论 |
| 取少量滤液于试管中,向其中滴加碳酸钠溶液 |
|
猜想Ⅰ正确 |
| 另取少量滤液于试管中,向其中滴加足量的 溶液。(填化学式) |
有气泡产生 |
猜想Ⅲ正确 |
【交流反思】兴趣小组经过讨论认为:
若猜想II正确,该原料中CaO与Na 2CO 3的质量比为 。
某学校化学兴趣小组同学在实验室发现一瓶忘了盖瓶盖的NaOH固体,对其成分是否变质以及变质程度产生了兴趣.同学们作出了以下猜想,并进行如下实验探究.
【提出问题】这瓶NaOH固体样品的成分是什么呢?
【作出猜想】猜想1:只含NaOH 猜想2:只含Na 2CO 3 猜想3:含有NaOH和Na 2CO 3
【讨论交流】NaOH可能变质的原因是 (用化学方程式表示)
【实验探究】(1)取少量样品于试管中,加入足量稀盐酸,有气泡产生,说明猜想 不成立.
(2)进一步他探究过程如下:
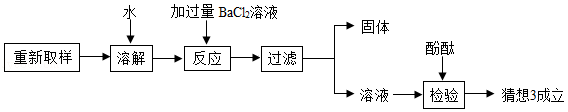
根据上述探究过程回答:
①加入过量BaCl 2溶液的作用是 ;
②不能用适量Ba(OH) 2溶液代替过量的BaCl 2溶液的原因是 ;
③下列溶液可用来代替酚酞试液检验猜想3成立的是 .
| A. |
CuCl 2溶液 |
B. |
KNO 3溶液 |
C. |
CaCl 2溶液 |
D. |
NH 4Cl溶液 |
【实验反思】实验室里,NaOH固体的保存方法是 .
向盛有氢氧化钠溶液的烧杯中滴加稀盐酸,搅拌后没有观察到明显现象.教材上借助酸碱指示剂验证了该反应的发生.是否还有其他方法判断该反应的发生呢?小明和小亮两位同学分别进行了实验探究.
【实验探究一】小明同学取上述反应后的溶液少许于试管中,向其中滴加硝酸银溶液,观察到有白色沉淀生成,再滴加足量的稀硝酸,沉淀不溶解.小明认为白色沉淀是NaCl与AgNO 3反应生成的,于是得出氢氧化钠与盐酸发生了反应的结论.
【实验探究二】小亮同学取一定量的稀盐酸于烧杯中,向其中逐滴加入氢氧化钠溶液,搅拌并用pH计精确测量烧杯中溶液的pH,绘制溶液的pH随时间变化的曲线如图1所示.小亮根据溶液pH的变化,推断盐酸与氢氧化钠发生了反应.
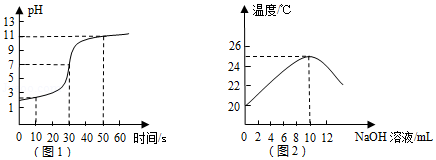
【讨论交流】(1)针对两位同学的实验探究,老师认为小明同学的结论是错误的,理由是 (用化学方程式表示).
(2)在小亮的实验中,当实验进行到10秒时,溶液中含有的溶质是 (填化学式),该溶液能与下列物质发生反应的是 (填序号).
①碳酸钠②氧化铜③硫酸铜 ④镁
(3)从图1的曲线中得知,当实验进行到 秒时,酸与碱恰好完全反应.
【拓展延伸】老师将氢氧化钠溶液逐滴加入到盛有稀盐酸的烧杯中,测定溶液的温度,绘制出溶液的温度随氢氧化钠溶液体积的变化而变化的曲线如图2所示,从能量变化的角度看,该反应属于 反应(填"吸热"、"放热").
【反思评价】有的中和反应没有明显现象,有的中和反应有沉淀生成或固体物质溶解的现象.请写出一个有沉淀生成的中和反应的化学方程式 .
矿物资源的综合利用,可以节约资源与能源.黄铁矿的主要成分为二硫化亚铁(FeS 2),黄铁矿煅烧的化学方程式:4FeS 2+11O 2═2Fe 2O 3+8SO 2.产生的SO 2用于生产硫酸,矿渣(含有少量的硫元素)用于冶铁.
查阅资料:SO 2气体能使品红溶液褪色,能使澄清石灰水变浑浊,反应的化学方程式为SO 2+Ca(OH) 2═CaSO 3↓+H 2O.
(1)FeS 2中硫元素的化合价为 .矿渣在炼铁高炉内反应产生的高炉气含CO、CO 2、SO 2等气体,其中 是形成酸雨的气体.
(2)某化学兴趣小组为检验高炉气中的CO、CO 2、SO 2,设计了如图所示装置(不考虑其他气体对该实验的影响).
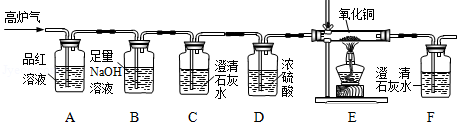
①该装置不能检验出的气体是 .
②装置B的作用是 .
③装置E中发生反应的化学方程式为 .
④确认高炉气中含CO的依据是 (填小写字母).
a.装置C中澄清石灰水变浑浊 b.装置C中澄清石灰水不变浑浊
c.装置E中黑色粉末变成红色 d.装置F中澄清石灰水变浑浊
(3)请指出该装置存在的一处明显缺陷 .
(1)实验是科学探究的重要手段,请按要求填写如表。
| 实验内容 |
蒸发结晶 |
稀释浓硫酸 |
| 实验操作 |
|
|
| 问题讨论 |
①当蒸发皿中出现 时,停止加热。 |
②烧杯中物质A的名称是 。 |
(2)如图是实验室制取和收集气体的装置,请按要求回答下列问题。

①仪器X的名称是 。
②实验室用高锰酸钾制取并收集较纯净的氧气,应选用的发生装置和收集装置的组合是 __ (填字母),该反应的化学方程式是 。
③实验室收集CO 2时,选用C装置而不选用D装置的理由是 ,CO 2气体应从C装置的 处(填"a"或"b")进入。
碱石灰是由CaO和NaOH固体组成的混合物,它是实验室常用的干燥剂。同学们在实验室里发现一瓶久置的碱石灰样品,为探究其成分,同学们对这包碱石灰样品展开了探究。
【查阅资料】BaCl2溶液显中性。
【提出猜想】该碱石灰样品的主要成分可能含有CaO、NaOH、CaCO3、Na2CO3和 。
【实验探究】
步骤Ⅰ:取部分该碱石灰样品于小烧杯中,加少量水后无放热现象,再继续加足量水,搅拌、静置后有白色沉淀产生。
步骤Ⅱ:取步骤Ⅰ小烧杯内的上层清液少量于试管中,滴加过量BaCl2溶液,有白色沉淀产生。
步骤Ⅲ:将步骤Ⅱ所得物质过滤,向滤液中滴加酚酞溶液,溶液变红色。
【解释与结论】
(1)该碱石灰样品中一定含有的物质是 ,一定不含有的物质是 。
(2)写出步骤Ⅱ中生成白色沉淀的化学方程式: 。
(3)步骤Ⅲ所得溶液中除酚酞外还含有的溶质是 。
【迁移应用】写出不能用碱石灰干燥的两种气体的化学式: 。
现有一包白色粉末,可能含有硫酸钠、碳酸钠、氯化钡、氢氧化钠、硫酸铜中的一种或几种,某化学小组为确定其成分,做了以下探究:
【查阅资料】硫酸钠、氯化钡溶液均呈中性。
(1)步骤Ⅰ:取少量固体于烧杯中,加足量的水,搅拌,过滤,得到白色沉淀和无色滤液。
步骤Ⅱ:取步骤Ⅰ所得的白色沉淀于试管中,加入过量的稀硝酸,沉淀全部溶解,有气泡产生,得到无色澄清透明的溶液。
根据上述两步实验,小组同学认为白色粉末中一定不含有的物质是 ,同时确定了白色粉末中一定含有的物质,并写出了步骤Ⅰ中产生白色沉淀的化学方程式是 。
(2)为了进一步确定白色粉末中可能含有的物质,小组同学利用步骤Ⅰ所得的滤液继续探究。
【讨论猜想】小组同学对滤液中溶质成分做出了多种猜想,其中滤液中含有三种溶质的猜想分别是:
猜想一: ;猜想二: 。
【实验探究】小组同学共同设计如下方案来证明诸多猜想中猜想二成立,请完成下列表格:
实验步骤 |
实验现象 |
实验结果 |
|
|
猜想二成立 |
【实验结论】小组同学通过以上探究,最终确定了白色粉末的成分。
学习了酸、碱、盐的化学性质后,某小组同学在实验室做了如下探究实验,请根据实验回答下列问题。
查阅资料信息:①氯化钡溶液和硫酸钠溶液均为中性溶液
②碳酸钡为白色沉淀
③硫酸钡不与酸反应
(1)将酚酞溶液滴入到碳酸钠溶液中,发现溶液变红,说明碳酸钠溶液显 (填“酸性”、“碱性”或“中性”)。
(2)如图所示,用胶头滴管将氯化钡溶液滴入到锥形瓶中,观察到有白色沉淀产生,液体呈红色,写 出该反应的化学方程式 。
(3)打开分液漏斗的活塞,继续向锥形瓶中滴入稀硫酸,观察到锥形瓶内有气泡产生并有白色沉淀,液体呈无色。试管内澄清的石灰水变浑浊,写出试管内反应的化学方程式 。
(4)实验结束后,小组同学将锥形瓶中的物质过滤,继续探究滤液中溶质的成分(酚酞除外),认为一定含有的溶质是 ,可能含有的溶质是 。
(5)设计实验,验证可能含有的溶质是否存在。请完成下列实验报告。
实验步骤 |
实验现象 |
实验结论 |
取滤液少许于试管中,加入 。 |
|
可能含有的溶质存在 |

小明在进行粗盐提纯和配制一定溶质质量分数的氯化钠溶液时,遇到了如下的问题,请你帮助小明来解答下列问题.
(1)粗盐提纯的步骤为:溶解、 、蒸发、计算产率.
(2)经过滤后,食盐水仍浑浊的可能原因是 (答一点即可).
(3)在蒸发实验操作中,当蒸发皿中出现 时停止加热.
(4)将配制好的氯化钠溶液,装入试剂瓶时不小心溅出,则剩余溶液中溶质的质量分数 (填“偏大”、“偏小”或“不变”).
有一包白色粉末可能含有氯化钡、碳酸钡、碳酸钠、氢氧化钠和硫酸钠中的一种或几种,取一定量该粉末样品加入到盛有足量水的烧杯中,搅拌,静置,观察到烧杯中有白色不溶物,小郑同学将烧杯中的物质过滤,得滤渣A和滤液B,取滤渣A于试管中滴加过量稀硝酸,观察到滤渣全部溶解,有气泡产生。
小杨同学进一步设计了如下实验方案,确定白色粉末的组成:

针对上述实验方案中各步骤的现象,小杨同学提出下列三种不同的假设,依据每种假设中各步骤不同的实验现象,可得出不同的实验结论。
| |
步骤一 |
步骤二 |
步骤三 |
| 假设一 |
有白色沉淀生成 |
|
|
| 假设二 |
无白色沉淀生成 |
溶液变红 |
溶液变为无色 |
| 假设三 |
无白色沉淀生成 |
无明显现象 |
无明显现象 |
(1)依据假设一的现象,可确定原白色粉末中只含有碳酸钡、碳酸钠、氢氧化钠和硫酸钠四种物质。则步骤二的现象是 ;步骤三的现象是 ;步骤三中发生的任意一个化学反应的化学方程式是 。
(2)依据假设二的现象,原白色粉末可能的组成是 ;(任写一种可能的组成,用化学式表示)
(3)依据假设三的现象,原白色粉末可能的组成有 种。
"酸、碱和盐的溶解性表(室温)"是学习化学的重要工具,智慧小组同学利用该工具进行探究学习.
探究活动一:认识工具
如图,表中标注了甲、乙、丙、丁和戊五种物质,物质的溶解性均未标明.
部分酸、碱和盐的溶解性表(室温)
| 阴离子 阳离子 |
OH ﹣ |
NO 3 ﹣ |
Cl ﹣ |
SO 4 2 ﹣ |
CO 3 2 ﹣ |
| K + |
甲 |
乙 |
|
丙 |
|
| Ba 2+ |
|
|
丁 |
|
戊 |
(1)认识符号:NO 3 ﹣名称是 ;
(2)写化学式:丙物质的化学式是 ;
(3)物质分类:五种物质中,属于碱的是 (用化学式表示);
(4)溶解能力:五种物质中,只有一种不溶于水,它是 (用化学式表示).
小明同学欲回收中考化学实验操作考试(考题:鉴别碳酸钠和氯化钠两瓶白色固体)用剩的药品。他对其中的一瓶药品是否纯净产生质疑,于是他在老师的指导下对其成分展开可如下探究:
【猜想与假设】猜想一:白色固体为碳酸钠;
猜想二:白色固体为氯化钠;
猜想三:白色固体为碳酸钠和氯化钠的混合物。
【设计与实验】
实验步骤 |
实验现象 |
实验结论 |
取少量固体药品,装入试管,加蒸馏水溶解,然后加入过量的稀硝酸,最后滴加几滴硝酸银溶液 |
若只有 产生 |
则猜想一正确 |
若只有白色沉淀生成 |
则猜想二正确 反应的化学方程式为 |
|
若先有气泡产生,后有白色沉淀生成 |
则猜想三正确 |
【实验结论】小明同学根据实验现象得出猜想三正确。
【反思评价】小明同学根据实验结论领悟到:老师强调加入稀硝酸并且至过量的目的是 。他认为,若只将实验步骤中的过量稀硝酸换成过量稀盐酸,重复以上实验操作,虽然也会产生相同的实验现象,但不能确认猜想三是否正确,理由是 。
【归纳总结】1.在选加试剂检验物质成分时,既要考虑除尽原有的干扰物质,又要防止 新的干扰物质。
2.在实验操作过程中,应规范操作以避免药品被 。
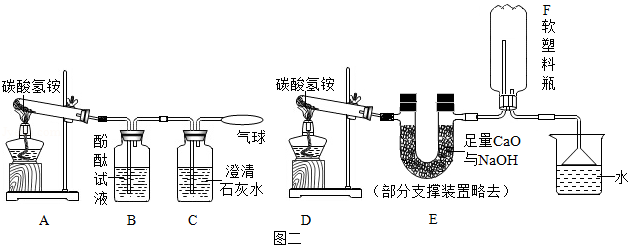
如图一是某食品标签,小颖看到食品添加剂中有"碳酸氢铵",感觉很惊讶,"碳酸氢铵"是臭粉啊,怎么可以放进食品?于是开展了以下探究,请你帮助完成下列相关问题。
(1)分析食品成分:营养物质:配料中含有多种营养物质,其中富含糖类的有 ;
食品添加剂:主要是盐类,酸类等物质。
(2)查阅资料:①食用级碳酸氢铵比较纯净,可作膨松剂,一般用在油炸食品中,水蒸食品中不用;
②常温常压下,1体积水约能溶解600体积氨气,其水溶液呈弱碱性。
(3)产生疑惑:臭粉为何可以作膨松剂?为何一般适用于油炸食品而不适用于水蒸食品?
(4)实验设计:实验装置如图,图二是检验装置,图三是收集装置,取适量碳酸氢铵分别置于两试管中,按如图进行实验。
(5)现象与分析:①图二:反应过程中的现象是 ,C中澄清石灰水变浑浊,当B中不再有气泡冒出时,A装置试管中固体消失、 。
②图三:装置E的作用是 ,F中收集到氨气,说明氨气具有 性质,取下F,塞上橡皮塞,用注射器向F中注入少量水,看到的现象是 ,拔出橡皮塞闻到氨味。
(6)解释与结论:①有臭味的碳酸氢铵添加到食品中,如果油炸,则含有的少量碳酸氢铵受热时完全分解,产生的气体使食品膨胀,且生成物可以迅速挥发而离开食品,没有残留物,其臭味会消失,碳酸氢铵发生反应的化学方程式是
②添加碳酸氢铵的食品如果水蒸,则 。
通过上述探究小颖明白了:高纯度的碳酸氢铵可以作为食品添加剂,但同一食品添加剂并不适合所有食品,使用食品添加剂需严格控制用量。