(11分)小明同学看到妈妈将买来的排水口洗净剂(主要成分:过碳酸钠、柠檬酸)洒在厨房排水口网状盖的底部,倒上温水后迅速冒出气泡.为了解其反应过程,他与学习小组的同学进行了如下探究.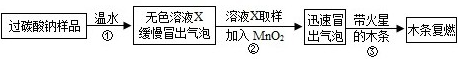
【探究一】小组同学根据所学的化学知识设计并进行了如图所示的实验.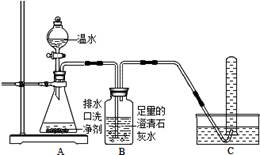
要保证实验的效果,实验装置要有良好的气密性,检查A装置气密性的方法是_________.实验中观察到如下现象:A中有气泡产生;B中的澄清石灰水变浑浊;C中收集到的气体能使燃着的木条燃烧更旺.由此同学们得出结论:生成的两种气体分别是_______、________(填化学式).
【探究二】
(1)实验过程:教师提供了一瓶过碳酸钠(Na2CO4),
小组同学进行了如下实验探究:
(2)提出问题:无色溶液X中的溶质有哪些物质?
(3)猜想与假设:根据以上实验现象,X溶液中一定存在的溶质是 _____;还可能存在Na2CO3、NaHCO3、NaOH中的一种或几种.写出上述实验探究中②反应的化学方程式__________.
(4)查找资料:
资料1:氯化钙溶液呈中性;氯化钙溶液与碳酸氢钠溶液混合不发生反应;
氯化钙溶液与碳酸钠溶液混合后发生如下反应:Na2CO3+CaCl2═CaCO3↓+2NaCl
资料2:NaHCO3溶液呈碱性,与石灰水反应生成白色沉淀;碳酸氢钠、碳酸钠与足量的酸反应产物相同.
(5)实验过程:小组同学对溶液X中的溶质进行了如下实验.请将下列实验方案填写完整.
| 实验操作 |
主要实验现象 |
结论 |
| ①____________________ |
_____________ |
证明溶液中有Na2CO3 |
| ②_________________ |
______________ |
证明溶液中既无NaHCO3又无NaOH |
(6)实验反思:①根据资料,Na2CO4与水反应的化学方程式为________________.②Na2CO3、NaHCO3两种物质性质上既有共性又有差异,其差异性可用于鉴别、______等.
纳米碳酸钙是一种重要的无机化工产品,下图是某厂生产纳米碳酸钙的工艺流程。
请回答下列问题:
(1)请完成并配平该工艺中生成CaCO3固体的反应方程式:
CaCl2+_________+CO2=CaCO3↓+__________+H2O
(2)若在实验室中进行该实验,操作l的名称是___________,使用到的非玻璃实验用品有_________、________。
(3)上述过程制得的碳酸钙粗品表面可能含有的可溶性杂质有___________(写一种化学式即可)。操作2为:_________、检验和干燥,检验操作中选用的试剂为____________(选择序号)。
①NH4Cl溶液 ②AgNO3溶液 ③CaCl2溶液 ④Ba(NO3)溶液
(4)上述流程中的副产品可用作_______________________________(写一种用途)。
海水是巨大的资源宝库,利用海水为原料获得许多化工产品的流程如下图: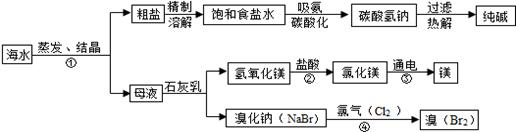
(1)实验室去除粗盐中难溶性杂质的一般步骤是:溶解、过滤、 、计算产率;
(2)步骤①中选用蒸发结晶而不用降温结晶的理由是 。
(3)由上述流程图看出碳酸氢钠的热稳定性 (填“大于、小于或等于)纯碱的热稳定性。
(4)步骤②发生的反应属于 反应(填一种基本反应类型)。用镁制造的一种镁铝合金常用作生产飞机外壳的材料,该材料具有的优良性能有 (任答一点)。
(5)步骤④发生的反应为置换反应(类似于金属与盐溶液之间的反应),
反应后溴元素的化合价比反应前 (填“升高”或“降低”或“不变”)。
(6)通过海水为原料制取纯碱中会含有杂质氯化钠,为了测定纯碱中杂质氯化钠的质量分数,小阳同学进行了三次实验,实验数据如下表:
| 编 号 |
第 1 次 |
第 2次 |
第 3次 |
| 所取固体样品的质量/g |
13 |
10 |
10 |
| 样品用98g水溶解后,加入CaCl2溶液的质量/g |
100 |
100 |
125 |
| 反应后生成沉淀的质量/g |
8 |
8 |
8 |
完成下列计算:
①固体样品中氯化钠的质量分数是 ;
②第 2 次反应结束后溶液中溶质质量分数是多少?(写出必要的计算题过程)
水是重要的资源。
(1)活性炭常用于净水,其作用是 。
(2)海水晒盐得粗盐,粗盐提纯的实验步骤为:溶解、 、蒸发结晶。
(3)水是一种重要的溶剂,(如图1)是硝酸钾和氯化钠的溶解度曲线。
①图中A点表示的含义是 。
②20℃,向50g水中加入25g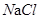 ,得到 溶液(填“饱和”或“不饱和”);若要增大该溶液中溶质的质量分数,其方法是 。
,得到 溶液(填“饱和”或“不饱和”);若要增大该溶液中溶质的质量分数,其方法是 。
(4)水在化学实验中具有重要作用,将光亮的铁丝固定在U型管左端的塞子上(如图2),几天后,观察到的实验现象为 ;从实验中可以得出铁生锈的条件是 。
2012年3月22日是第二十届“世界水日”。水与人类的生活和生产密切相关。
(1)下列做法有助于保护水资源的是 。
A.禁止向河流中排放废水
B.禁止向乱扔垃圾
C.节约用水
(2)水的硬度过大会影响生产和生活,区分软水和硬水常用的物质是 。生活中可以通过________的方法来降低水的硬度。
(3)自来水厂净水过程为:天然水→加絮凝剂→沉降→过滤→吸附→加消毒剂→自来水。通常使用的絮凝剂是 ;X是一种新型的自来水消毒剂,制取X的化学方程式为:C12+2NaClO2=2NaCl+2X,则X的化学式为 。
(4)下图为甲、乙(均不含结晶水)两种固体物质在水中的溶解度曲线。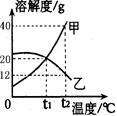
①溶解度随温度升高而增大的物质是 (填“甲”或“乙”);t1℃时,甲的溶解度_______乙的溶解度(填“大于”或“小于”或“等于”)。
②某同学在t1℃时开始如下实验,得到相应的溶液A、B、C。
在溶液A、B、C中,属于饱和溶液的是___________;与溶液C质量相等的是______。
在溶液C中再加入25g甲后,充分搅拌,恢复到t2℃,所得溶液的质量为______。
为维护食品安全,卫生部公告自2011年5月1日起,禁止在面粉生产中添加增白剂及过氧化钙等.
(1)过氧化钙的化学式为CaO2,其中氧元素与钙元素的质量比为 。
(2)正确看待和安全使用食品添加剂非常重要.下图是超市售卖的2种不同品牌橙汁的标签。

①2种橙汁均属于 (填“纯净物”和“混合物”).
②你更倾向于选择的品牌是: (填“A”或“B”)为防范添加剂危害,选购包装食品时应 (至少一条)。
(5)(3分)过氧化钙在养鱼时可用作增氧剂,多少克过氧化钙(CaO2)和49克氯酸钾(KClO3)中含氧元素的质量相等?(写出计算过程)
水是重要的物质,在实验室中常用于溶解物质、配制溶液。
(1)向50mL水(密度为1g/mL)中溶解一定量的KNO3固体的操作如下,请根据下图实验现象和溶解度曲线回答。
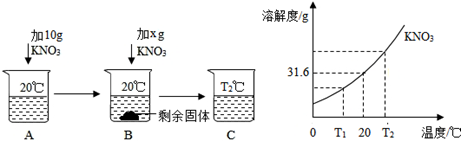
A、B、C中一定是饱和溶液的是 ,一定是不饱和溶液的是 ;(填字母)
‚当χ= g时,B中恰好没有固体剩余;ƒ硝酸钾林溶液中析出晶体常用 方法。
(2)根据下列仪器,欲配制一定质量分数的食盐溶液,回答下列问题。
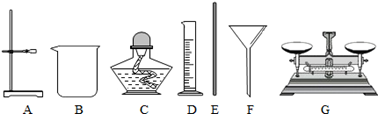
上面的仪器中除D、E外,还必须选用的仪器有 ;(填字母)
‚E的作用是 ,配制的步骤可以概括为计算、称取和量取、 、装瓶贴标签。
有一包固体,可能由氯化铜、硫酸钠、氯化钠、碳酸氢钠中的一种或几种组成。为了探究该固体的组成,某化学小组设计并开展以下实验: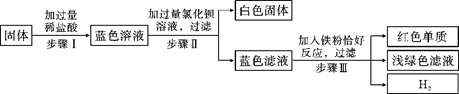
已知,步骤Ⅰ中固体全部消失,溶液呈蓝色,无气泡产生。请回答下列问题
(1)原固体中一定含有的物质是___________。
(2)原固体中一定不含有的物质是___________,证据是___________。
(3)任写一个步骤Ⅲ中发生反应的化学方程式___________。
(4)步骤Ⅲ所得浅绿色滤液中一定含有的溶质是___________。
化学支撑科技,化学改变生活。请结合所学知识回答:
(1)“材料创新”标志着人类文明的进步。
①“神舟十号”飞船的发射让航天员再次访问“天宫一号”。资源舱舱段使用了铝锂合金材料代替传统材料,铝锂合金属于________材料(“金属”“合成”或“复合”)。
②据《苍梧晚报》报道:国内首把碳纤维小提琴由某集团碳纤维应用研究中心研发制造,其中碳纤维属于________材料(填“金属”或“合成”或“复合”)。
(2)“科学膳食”是人类健康的保障。
小明的食谱中缺少富含维生素的食物,你建议他增加________(填一种);当他剧烈运动大量出汗后,你建议他饮用含________的运动饮料(填六大营养素之一)。
(3)“安全意识”在我们心中共鸣。
①天然气或沼气(主要成分均为CH4,其密度小于空气)已在城乡普遍入户,万一燃气泄漏,应采取的措施是______________,为了及时发现漏气,可在厨房墙壁的________方安装报警器(填“上”或“下”)。
②稀释浓硫酸时,为了防止酸液溅出造成伤害,操作时一定要注意________(填“水入酸”或“酸入水”),并缓慢注入,且用玻璃棒不断________(填操作名称)。
如图所示,A、B、C是初中化学中常见的三种单质,甲、乙、丙是三种氧化物。甲和C为黑色的固体,A、乙、丙为无色气体,
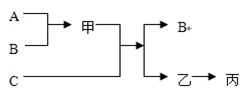
根据它们的转化关系回答问题:
(1)写出下列各物质的化学式:B ,甲 ,乙 。
(2)写出有关反应的化学方程式。
甲和C反应的化学方程式为 ;
乙生成丙的化学方程式为 。
(5分)A~H是初中化学常见的物质,A和C的组成元素相同;B为单质;D为常见的碱,俗称熟石灰;E为一种常见的建筑材料.它们的相互转化关系如图所示(反应条件、部分生成物已略去)。
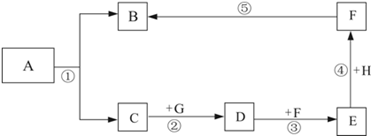
(1)写出下列物质的化学式为:A ; B ; F 。
(2)请写出第③步的化学方程式: 。
(3)反应⑤在实际中的意义是 。
根据复分解反应发生的条件,判断稀硫酸与下表中的四种化合物的溶液之间能否发生反应,将表中内容补充完整.
| 氢氧化钠溶液 |
氯化钠溶液 |
碳酸钾溶液 |
硝酸钡溶液 |
|
| 稀硫酸 |
能反应 |
不能反应 |
能反应 |
|
| 判断依据 |
有水生成 |
没有水、气体、沉淀生成 |
【提出问题】稀硫酸与氢氧化钠溶液的反应没有观察到明显现象,是否真的发生了反应?
【实验方案】小丽同学设计实验方案进行探究,证明氢氧化钠溶液与稀硫酸发生了反应,请你和她一起完成实验报告.
| 实验操作 |
实验现象 |
| ①向试管中加入约2稀氢氧化钠溶液,滴加2滴溶液 |
|
| ②向①所得液体中滴加过量稀硫酸 |
【实验结论】稀硫酸与氢氧化钠溶液发生了反应;
【实验拓展】小丽结合所学知识,认为初中常见的酸碱之间一定能发生复分解反应,她判断的依据是.
化工生产中需要对原料提纯,以利于提高产品质量。经测定某氯化钠样品中混有硫酸钠,为了除去杂质并制得纯净的氯化钠固体,在实验室研究中某学生设计方案如下:
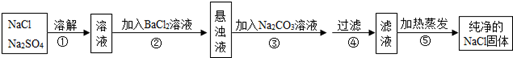
回答下列问题
(1)操作②能否用硝酸钡溶液?说明理由;
(2)进行操作②后,如何判断硫酸钠已除尽,方法是;
(3)操作③的目的是,③、④操作顺序能否交换,其理由是;
(4)此设计方案是否严密,说明理由.
以下是我们日常生活中常用各种清洗剂。
| 名称 |
洗涤灵 |
洁厕灵 |
炉具清洁剂 |
活氧彩漂 |
污渍爆炸盐 |
| 产品样式 |
 |
 |
 |
 |
 |
| 有效成分 或功能 |
清洗油污 |
盐酸 |
氢氧化钠 |
过氧化氢 |
过碳酸钠 |
(1)我们使用洗涤灵清洗餐具上的油污,这是因为它具有 的功能。
(2)清除以下物质,可以使用洁厕灵的是 填字母序号)。
A.铁锈 B.水垢(主要成分为碳酸钙和氢氧化镁)
C.油渍 D.氢气还原氧化铜实验后,试管内壁残留的红色固体
(3)“污渍爆炸盐”溶于水后会生成Na2CO3和H2O2。将爆炸盐溶于水后,再加入足量的洁厕灵,产生能使澄清石灰水变浑浊的气体,这一反应了体现右图中 (选填①②③④)性质关系。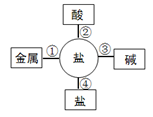
(4)将洁厕灵滴入炉具清洁剂中,如图甲所示。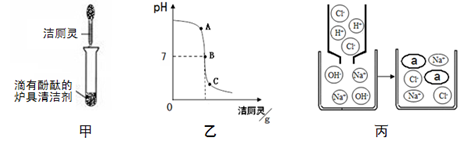
①若反应后溶液呈红色,则反应后溶液中的溶质是(酚酞除外) ;此时溶液可用图乙中 点处(选填A、B、C)表示。
②若反应后溶液pH为7,图丙中a微粒的化学式为 。
(5)①“活氧彩漂”可用于漂洗衣物、杀菌消毒等,原因是其有效成分过氧化氢分子中含有“过氧基”(—O—O—)。据此推测,下列物质中,可用作杀菌消毒剂的是 (填序号)。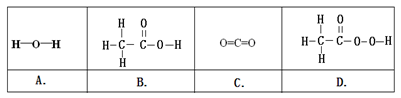
②氧化氢溶液常用于医用消毒,某兴趣小组为测定一瓶久置的医用过氧化氢溶液中溶质质量分数。他们取该溶液51g,加入适量二氧化锰,生成氧气的质量与反应时间的关系如图所示。试计算该过氧化氢溶液中溶质的质量分数。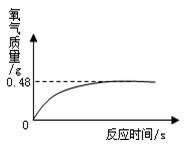
(写出计算过程)
铁及其化合物在生活生产中有重要的应用。请回答下列问题:
(1)铁制品在空气中易锈蚀,其实质是铁与空气中的氧气、 等接触后发生化学反应的过程。
(2)在盛有氧气的集气瓶中点燃细铁丝发生剧烈燃烧的化学方程式是 。为防止集气瓶破裂,常采取的措施是 。
(3)把铁粉和铜粉的混合物放入硝酸银溶液中,充分反应后,过滤,为确定滤渣和滤液的成分,甲同学向滤渣中滴加稀盐酸,无气泡产生; 乙同学向滤液中滴加稀盐酸,产生白色沉淀。根据两同学实验的现象,分析下列结论不正确的是 (填写字母序号)。
A.滤渣中只含银 B.滤渣中一定含有银,可能含有铜
C.滤液中一定有Ag+ 、Fe2+ 和Cu2+ D.滤液中只含Ag+ 和Fe2+,不含Cu2+
【探究】废旧金属的回收利用。
废铁屑的主要成份是铁,同时还有少量铁锈(Fe2O3),生产动物饲料添加剂硫酸亚铁的工艺之一如下图所示: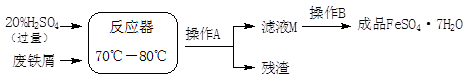
(4)在反应器中发生反应的化学方程式有:
Fe + H2SO4 =FeSO4 +H2↑、 、 Fe2(SO4)3 + Fe = 3FeSO4。
(5)滤液M中肯定含有的溶质的化学式是 ;
(6)在化学反应中,凡是有元素化合价变化的反应属于氧化还原反应。下列反应类型肯定属于氧化还原反应的是 (填字母编号);
A.化合反应 B.置换反应 C.分解反应 D.复分解反应
(7)取表面含有氧化镁的镁条(无其它杂质)2.5g,加入到足量的20.0g的稀硫酸中,充分反应后,所得溶液的质量为22.3g。求:该镁条中单质镁的质量分数。