面粉是制作美食的原材料。在发面团的过程中会生成酸而影响口味,为使食品更美味,可以加碱面处理。碱面的主要成分为碳酸钠(Na2CO3),为测定某品牌碱面中碳酸钠的质量分数,小金按照如图甲所示实验装置,利用碱面与盐酸反应生成二氧化碳气体的质量来计算碱面中碳酸钠的质量分数(杂质不与盐酸反应)。
完成下列问题:
(1)为完成碳酸钠质量分数的测定实验,气体发生装置应选择图乙中的 装置(填字母)。
(2)小金各取11.0克碱面样品与一定量的稀盐酸进行三次实验,三次实验所采集的数据见表。合理选择表中数据并计算碱面中碳酸钠的质量分数;
实验次数 |
碱面样品质量/克 |
稀盐酸质量/克 |
二氧化碳质量/克 |
1 |
11.0 |
50.0 |
1.1 |
2 |
11.0 |
200.0 |
4.4 |
3 |
11.0 |
250.0 |
4.4 |
(3)按照图甲实验装置测定的CO2气体质量,可能导致CO2质量测定结果偏小的原因 (写出一种即可)。
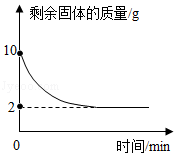
某课外兴趣小组同学取一定量含铜粉的氧化铜粉末,放入烧杯中,加入192g稀硫酸,搅拌,恰好完全反应后过滤(损耗忽略不计),烧杯中固体的质量随时间变化情况如图所示。
(1)所取粉末中氧化铜的质量为 g;
(2)计算反应后所得溶液溶质质量分数。(规范写出计算过程)
同学要通过实验来测定某品牌的纯碱样品中Na2CO3的质量分数。他们取了6g纯碱样品放入烧杯中,再将80g一定溶质质量分数的稀盐酸分4次加入该烧杯中,充分反应后测得实验数据如下表(不考虑CO2溶解于水)。
实验次数 |
1 |
2 |
3 |
4 |
加入稀盐酸的质量/g |
20 |
20 |
20 |
20 |
烧杯中剩余物质的质量/g |
25.2 |
m |
63.8 |
83.8 |
(1)表格中m的值为 。
(2)样品中Na2CO3的质量分数是多少?(写出计算过程,计算结果精确到0.1%)
用光卤石为原料提取的氯化钾产品中含有氯化镁杂质,产品等级中氯化钾指标为:
指标名称 |
优良品 |
一级品 |
二级品 |
氯化钾质量分数(≥) |
93.00% |
90.00% |
87.00% |
为确定某氯化钾产品等级进行了以下实验:
步骤一(溶解):取40.0g氯化钾产品溶于水,配制成溶液。
步骤二(沉淀):向步骤一所得溶液中加入过量的质量分数为10%的氢氧化钾溶液112.0g,充分反应后过滤,得2.9g沉淀和一定质量的滤液。
步骤三(回收):向步骤二所得滤液中加入盐酸至溶液呈中性,得到400.0g溶液,将所得溶液蒸发结晶,回收氯化钾固体。
回答下列问题:(提示:KCl溶液呈中性;不考虑实验过程中的损失)
(1)通过计算判断该产品的等级。(写出解题过程)
(2)步骤三所得溶液中氯化钾的质量分数为 。
面粉是制作美食的原材料。在发面团的过程中会生成酸而影响口味,为使食品更美味,可以加碱面处理。碱面的主要成分为碳酸钠(Na2CO3),为测定某品牌碱面中碳酸钠的质量分数,小金按照如图甲所示实验装置,利用碱面与盐酸反应生成二氧化碳气体的质量来计算碱面中碳酸钠的质量分数(杂质不与盐酸反应)。
完成下列问题:
(1)为完成碳酸钠质量分数的测定实验,气体发生装置应选择图乙中的 装置(填字母)。
(2)小金各取11.0克碱面样品与一定量的稀盐酸进行三次实验,三次实验所采集的数据见表。合理选择表中数据并计算碱面中碳酸钠的质量分数;
实验次数 |
碱面样品质量/克 |
稀盐酸质量/克 |
二氧化碳质量/克 |
1 |
11.0 |
50.0 |
1.1 |
2 |
11.0 |
200.0 |
4.4 |
3 |
11.0 |
250.0 |
4.4 |
(3)按照图甲实验装置测定的CO2气体质量,可能导致CO2质量测定结果偏小的原因 (写出一种即可)。
实验室用碳酸钠溶液与氯化钙溶液反应制取高纯度碳酸钙粉末,烧杯中现有100g碳酸钠溶液,将140g氯化钙溶液分四次加入,充分反应,
注:发生反应的化学方程式为:CaCl2+Na2CO3 ═CaCO3↓+2NaCl
四次测量所得数据如表所示:
次数 |
累计加入氯化钙溶液的质量/g |
烧杯中溶液的总质量/g |
一 |
40 |
135 |
二 |
80 |
170 |
三 |
120 |
205 |
四 |
140 |
225 |
(1)恰好完全反应时,生成沉淀的总质量为 g。
(2)第四次测量时,所得溶液中的溶质有 (填化学式)
(3)计算氯化钙溶液的溶质质量分数(写出计算过程,计算结果保留到0.1%)
某兴趣小组同学将100g氢氧化钠溶液分五次加入到139.6g硫酸铜溶液中,测得实验数据如下表所示:
| |
第一次 |
第二次 |
第三次 |
第四次 |
第五次 |
| 氢氧化钠溶液的质量/g |
20 |
20 |
20 |
20 |
20 |
| 沉淀质量/g |
4.9 |
9.8 |
m |
19.6 |
19.6 |
(1)表格中m的值为多少。
(2)计算恰好完全反应时所得溶液中溶质的质量分数。(写出计算过程)
实验室为了测定过氧化氢溶液的质量分数,称取85.00g H2O2溶液和2.00g MnO2混合放入质量为50.00g的烧杯中,用电子天平称得烧杯的总质量随时间变化如表所示:
时间/S |
15 |
30 |
45 |
60 |
75 |
90 |
烧杯总质量/g |
136.5 |
136.1 |
135.70 |
135.50 |
135.40 |
135.40 |
(1)产生O2的质量为 g。
(2)过氧化氢溶液中溶质的质量分数为?(写出计算过程)
亚硝酸钠是一种工业用盐,外形与食盐相似,有咸味,有毒。人若误食会引起中毒,甚至致人死亡。已知亚硝酸钠的水溶液呈碱性,食盐水溶液呈中性。
(1)鉴别亚硝酸钠和氯化钠,你会选用什么试剂? ,如何操作? 。
(2)某实验小组成员李雷从人教版普通高中教科书《化学1》中得知碳酸钠的水溶液也呈碱性。该组成员就碳酸钠溶液呈碱性的原因进行了如下初探:
【查阅资料】
Ⅰ.大多数可溶性的盐溶解在水中会完全解离,产生自由移动的阴阳离子。如Na2CO3、KCl等。
Ⅱ.难溶性物质在水中解离出的阴阳离子极少,忽略不计。如CaCO3、BaCO3等。
Ⅲ.CaCl2的水溶液呈中性。
【猜想与假设】猜想Ⅰ:碱性是由溶液中解离出的Na+引起的;
猜想Ⅱ:碱性是由溶液中解离出的CO32﹣引起的;
………………
【实验设计】
实验步骤 |
实验现象 |
向1支洁净的小试管中加入3mL饱和碳酸钠溶液,滴入3滴酚酞溶液,振荡,再逐滴滴入氯化钙溶液至过量 |
试管中溶液颜色先由无色变为红色,然后逐渐变浅至消失 |
写出上述实验步骤中滴入CaCl2溶液后红色变浅至消失的原因 (用化学方程式解释)。
【实验结论】 。
【实验拓展】据此判断下列物质的水溶液可能使酚酞溶液变红的是 (填字母)。
A.CaCl2
B.CaCO3
C.H2SO4
D.K2CO3
【总结反思】该组同学善于发现问题,并设计实验探究问题。通过本次探究,他们认识到,并不是碱溶液才显碱性,盐溶液也可能呈碱性。他们还会进一步查阅资料探寻碳酸钠溶液呈碱性的本质原因和基本规律。
垃圾分类就是新时尚。目前,践行“新时尚”的垃圾分类工作已在全国地级及以上城市全面启动。
(1)生活垃圾可分为可回收垃圾、餐厨垃圾、有害垃圾等。
①空饮料瓶、废旧报纸应放置于贴有标志 (填字母序号,下同)的垃圾箱中。
②废旧电池中含有铅、镉、汞等有害金属,如果将其随意丢弃,这些金属渗出会造成土壤及 污染,威胁人类健康,应将其放入废旧电池专用收集箱。
③餐厨垃圾是生活垃圾的主要来源。下列有关说法合理的是 。
A.餐厨垃圾沥干水分后放入家用垃圾袋
B.部分餐厨垃圾可作为沼气池中发酵的原料
C.外出就餐提倡“光盘行动”
(2)垃圾是“放错了地方的资源”。
①部分废旧塑料具有 (选填“热塑”或“热固”)性,可反复加工再利用。
②某化学兴趣小组从工厂收集到一份金属废料,可能含有Al、Zn、Fe、Ag四种金属中的一种或几种,为测定其组成,便于回收利用,现取样向其中加入一定质量的CuSO4溶液。
Ⅰ.充分反应,得到无色溶液及少量固体剩余物,且反应前后溶液的质量相等。该金属废料中一定含有 (填元素符号)。
Ⅱ.将Ⅰ中少量固体剩余物置于试管中,加入足量稀盐酸充分反应, (选填“一定有”、“可能有”或“一定没有”) H2生成。
③建筑工地废弃的大理石边角料(主要成分为CaCO3,杂质不参加反应)可用于制备轻质碳酸钙(常用作牙膏中的摩擦剂)。已知:CaCO3 CaO+CO2↑

Ⅰ.操作a的具体步骤包括 、洗涤、干燥。
Ⅱ.计算10g大理石边角料理论上最多得到轻质碳酸钙的质量(写出计算过程)。

以FeSO4•7H2O为原料制备铁红(Fe2O3)的一种方法如图:

已知“沉淀”时的主要反应为:2FeSO4+H2O2+2H2O═2FeO(OH)↓+2H2SO4
(1)FeO(OH)中铁元素的化合价为 。FeO(OH)可表示为mFe2O3•nFe(OH)3, 。
(2)“沉淀”时需控制溶液的pH与反应的温度。
①“沉淀”时调节溶液的初始pH约为4,过程中应始终保持溶液的pH为3.0~4.5,需不断加入物质Z调节溶液的pH,Z应具备的性质有 (填字母)。
A.能与酸反应
B.能与碱反应
C.不与FeO(OH)反应
②“沉淀”时反应温度不宜过高,其原因是 。
(3)“过滤”后需对固体进行洗涤与干燥。洗涤时被除去的沾于固体表面的阴离子为 (填离子符号)。
(4)“煅烧”时反应的化学方程式为 。
(5)如图为其他条件相同时不同煅烧温度对产品中Fe2O3质量分数的影响。煅烧温度较低时,产品中Fe2O3质量分数较低,其原因是 。当煅烧温度达800℃时,继续升高温度,产品中Fe2O3质量分数降低,且铁元素质量分数升高,所得产品发黑,其可能原因是 。

(6)用该方法制备Fe2O3,计算理论上13.9t FeSO4•7H2O(相对分子质量为278)可制得Fe2O3的质量(写出计算过程)。
"84消毒液"是一种常用含氯消毒用品,有效成分是次氯酸钠(NaClO)。使用时,可根据实际需求进行配比,并规范使用,以防引发危险。
(1)"84消毒液"中的有效氯来自次氯酸钠,计算次氯酸钠中氯元素的质量分数。(计算结果精确到0.1%)
(2)现需要5L有效氯浓度为500mg/L的稀溶液,选用有效氯浓度为50000mg/L的某品牌"84消毒液"进行配制,需加水多少升?( 忽略混合前后溶液体积的变化)
(3)"84消毒液"不能与洁厕灵混合使用,因为"84消毒液"里的次氯酸钠与洁厕灵里的盐酸会发生化学反应,产生的氯气对人体有害,不同浓度氯气对人体的影响如表所示。
| 浓度(mg/m 3) |
对人体的影响 |
| 3000 |
可立即麻痹呼吸中枢,导致瞬间死亡 |
| 120﹣170 |
极为危险,会引起急性肺水肿及肺炎 |
| 40﹣60 |
在1小时内便可致人严重中毒 |
通过计算分析,在10米 3密闭空间里,若将1.49克次氯酸钠与盐酸完全反应,产生的氯气会对人体造成怎样的影响?(次氯酸钠与盐酸反应的化学方程式为:NaClO+2HCl═NaCl+Cl 2↑+H 2O)
中国北斗,星耀全球﹣﹣6月23日,由氢氧发动机提供动力的长征三号乙火箭成功将北斗三号最好一颗全球组网卫星送上太空。已知火箭将卫星送入预定轨道需要44t液氢(H2),则使液氢完全燃烧需提供液氧(O2)多少吨?
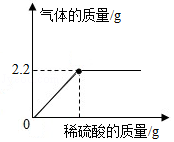
某纯碱样品中含有少量的氯化钠,某化学兴趣小组欲测定其中碳酸钠的质量分数。他们称取6.0g样品放入锥形瓶中,加入稀硫酸直到不再产生气体为止,反应中生成气体的质量与加入稀硫酸的质量关系如图所示:
计算:
(1)反应生成的二氧化碳的质量为 g。
(2)该纯碱样品中碳酸钠的质量分数(写出计算过程,计算结果精确到0.1%)。
(反应的化学方程式为:Na2CO3+H2SO4═Na2SO4+CO2↑+H2O)
市场上常见的苏打水有苏打气泡水和无汽苏打水两种。它们的主要成分中都含有碳酸氢钠,俗称小苏打,具有以下性质。
性质一:2NaHCO 3 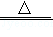 Na 2CO 3+H 2O+CO 2↑(NaHCO 3在50℃以上开始逐渐分解)
Na 2CO 3+H 2O+CO 2↑(NaHCO 3在50℃以上开始逐渐分解)
性质二:NaHCO 3+HCl═NaCl+H 2O+CO 2↑
(1)苏打气泡水中含有大量二氧化碳,瓶盖一打开就有大量气泡产生,所以叫气泡水。无汽苏打水则不含二氧化碳,但小明认为他喝入体内也会产生二氧化碳,主要是利用了碳酸氢钠的性质 (选填"一"或"二"),理由是 。
(2)小明查阅了相关资料想自制苏打水,于是购买了一袋小苏打,包装袋上标注的碳酸氢钠含量是99%。真的有这么高吗?小明取了10克小苏打样品放入装置,逐次加入稀硫酸进行实验,得到相关数据。请通过计算帮助小明判断包装袋上的标注是否准确。(2NaHCO 3+H 2SO 4═Na 2SO 4+2H 2O+2CO 2↑)

| 序号 |
反应前 |
第1次 |
第2次 |
第3次 |
第4次 |
第5次 |
| 加入稀硫酸溶液质量/克 |
0 |
10 |
10 |
10 |
10 |
10 |
| C装置中溶液总质量/克 |
100.0 |
101.1 |
102.2 |
103.3 |
104.4 |
105.0 |
(3)如果去掉装置B,测量结果将会 (选填"偏大"或"偏小")。