某兴趣小组同学将100g氢氧化钠溶液分五次加入到139.6g硫酸铜溶液中,测得实验数据如下表所示:
| |
第一次 |
第二次 |
第三次 |
第四次 |
第五次 |
| 氢氧化钠溶液的质量/g |
20 |
20 |
20 |
20 |
20 |
| 沉淀质量/g |
4.9 |
9.8 |
m |
19.6 |
19.6 |
(1)表格中m的值为多少。
(2)计算恰好完全反应时所得溶液中溶质的质量分数。(写出计算过程)
南通滨临长江,将长江水净化处理可成为居民生活用水。
(1)水净化时先加入絮凝剂,沉降过滤后,通过活性炭。活性炭的作用是 。
(2)将硬水通过如图所示的阳离子交换柱后可变成软水(图中阴离子未画出),交换后的水仍然呈电中性。
①一个Ca2+可以交换出 个Na+。
②阳离子交换柱长时间使用后,Na+变少,失去硬水软化功能而失效。利用生活中常见物质检验阳离子交换柱已失效的方法是 。
(3)二氧化氯(ClO2)可用于饮用水的杀菌消毒。取100mL经ClO2消毒后的饮用水于锥形瓶中,调节溶液至弱碱性,加入足量KI充分反应,测得生成I2的质量为0.0254mg。上述过程中发生的反应为2ClO2+2KI═2KClO2+I2,其他物质不参与反应。计算该饮用水中ClO2的残留量(以mg/L计),在答题卡上写出计算过程。

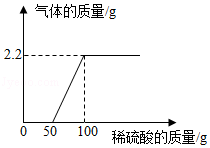
某校化学兴趣小组同学,将一定量的稀硫酸滴入9.3g氢氧化钠和碳酸钠的固体混合物中,产生气体质量与滴入稀硫酸的质量关系如图所示。试计算:
(1)产生二氧化碳气体的质量为 ;
(2)混合物与稀硫酸恰好完全反应时所得溶液中溶质的质量是多少?
“二氧化碳的实验室制取与性质”实验活动产生的废液中含稀盐酸,需先测定其溶质质量分数后进行处理。(杂质不参加反应)
(1)实验时需配制50g 5%的氢氧化钠溶液,若用氢氧化钠固体和水来配制。则需称量氢氧化钠固体的质量为 g。
(2)取20g废液样品于烧杯中,向其中逐滴加入5%的氢氧化钠溶液,恰好完全反应时共消耗氢氧化钠溶液16g。计算废液中盐酸的溶质质量分数。(写出计算过程)
(3)恰好完全反应时烧杯中的溶液所含粒子数目关系:Na+ Cl﹣. (填“>”、“=”或“<”)。
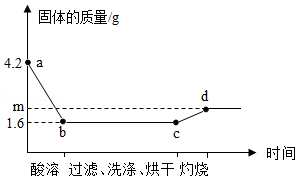
取一定量铜粉、铁粉的混合物,加入过量稀硫酸,完全反应(酸溶)后过滤,将滤渣洗净、烘干后在足量氧气中充分灼烧(金属元素在产物中显+2价)。固体质量与各步实验的时间关系如图。(1)b点时溶液中溶质的化学式为 。
(2)原粉状混合物中铁粉的质量为 g。
(3)求m的值。(写出计算过程)
溶液在生产、生活中起着十分重要的作用。某学习小组的同学对溶液的性质进行探究。
[引发思考]
生理盐水是医疗上常用的一种溶液,100mL生理盐水(其密度可近似看做lg/cm3)中含有0.9g医用氯化钠,该溶液中溶质的质量分数为 。一瓶合格的生理盐水密封放置一段时间后,不会出现浑浊现象,原因是 。
[提出问题]
溶液的某些性质是否可以通过定量实验进行验证?
[查阅资料]
电导率传感器用于测量溶液的导电性强弱:一定条件下,电导率的大小能反映离子浓度的大小。
[实验探究1]
氯化钠溶于水形成溶液的过程中氯离子浓度电导率的测定。
第一步:读取室温为26℃,取100mL蒸馏水,加入烧杯中,放入磁力搅拌器磁珠;
第二步:校准传感器,组装仪器,设定搅拌档位;
第三步:用氯离子传感器和电导率传感器同时采集数据,迅速将定质量的氯化钠加入烧杯中。实验数据如图1所示。

分析图1实验数据:
(1)a~b段曲线呈这种形态的原因是 。
(2)请说明实验过程中液体的电导率变化的原因 。
[交流反思1]
如何通过实验验证氯化钠溶液是均一的?请简要说明。 。
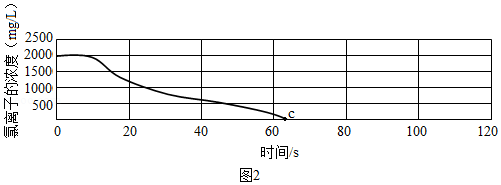
[实验探究2]用氯离子传感器和电导率传感器同时采集数据,向一定体积、一定浓度的氯化钠溶液中慢慢加入等体积、一定浓度的硝酸银溶液,恰好完全反应。部分实验数据如图2所示。
[交流反思2]
推测c点时溶液的电导率是否为零,并说明理由。 。
为了测定某银、锌合金(假设合金中只含银和锌)中银的质量分数,某同学称取20g银锌合金粉末进行实验,现将125g稀硫酸分五次加入合金粉末中,充分反应后测得生成气体的总质量如表所示:
| |
第1次 |
第2次 |
第3次 |
第4次 |
第5次 |
| 滴入稀硫酸的质量/g |
25 |
25 |
25 |
25 |
25 |
| 生成气体的总质量/g |
0.05 |
m |
0.15 |
0.20 |
0.20 |
请完成下列问题:
(1)表中m的值为 ;
(2)银、锌合金中银的质量分数为 ;
(3)所用稀硫酸的溶质质量分数是多少?(写出具体计算过程)
在100g的某盐酸中加入硝酸银溶液,反应为AgNO3+HCl═HNO3+AgCl↓,至恰好完全反应,经过滤、洗涤、干燥、称量得到质量为28.7g的AgCl沉淀,求盐酸的溶质质量分数。
合金是重要的金属材料,常用来制造机械零件、仪表和日用品。某化学研究小组利用黄铜(铜、锌合金)进行了如图所示实验:
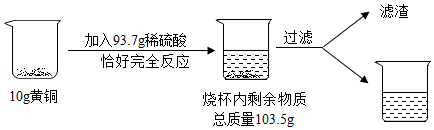
请计算:
(1)生成氢气的质量为 g,黄铜中锌的质量为 g;
(2)过滤后所得溶液的溶质质量分数。
现有含氯化钠杂质的碳酸钠样品,取6.95g样品溶于水,配制成52.2g溶液。此溶液与50g某溶质质量分数的盐酸恰好完全反应,得到100g溶液。请分析计算:
(1)生成二氧化碳的质量是 。
(2)所得溶液中溶质的质量分数(写出计算过程)。
某化验室用20%的氢氧化钠溶液洗涤一定量工业产品中残余的H2SO4(工业产品及其他杂质都不与氢氧化钠溶液反应),当恰好完全反应时,共消耗氢氧化钠溶液80g,求产品中残余的H2SO4质量和生成硫酸钠的质量。
阅读下列材料,回答问题:
材料一:研究人员发现大气层中特别是南极上空的臭氧层日益变薄。进入大气平流层的氯氟烃(一类合成有机化合物,应用于冰箱和空调的制冷剂、灭火器等)是造成臭氧层变薄的主要原因。因为在紫外线的照射下,平流层中的臭氧存在如下平衡:O 3 O 2+O;而氯氟烃进入平流层后会分解产生氯原子(Cl),进而发生下列反应:Cl+O 3→ClO+O 2;ClO+O→Cl+O 2
研究表明:平流层中1个氯原子大约可以破坏1×10 5个臭氧分子。氯氟烃分解产生的氯原子在上述反应中起着 作用。
工业纯碱中含少量氯化钠。兴趣小组分别采用不同的方法测定工业纯碱样品中碳酸钠的质量分数。
(1)方法一:差量法。称取W克样品与足量的稀盐酸充分反应,生成的二氧化碳通过装有试剂X的乙装置,并利用测量乙装置增加的质量,求得样品中碳酸钠的质量分数。该方法中试剂X可选用 。
(2)方法二:沉淀法。称取15克样品完全溶解于水中配成60克样品溶液,取三个烧杯分三次进行实验,每次加入30克氯化钙溶液充分反应,过滤、洗涤、干燥所得的沉淀质量记录如表。计算样品中碳酸钠的质量分数。
(Na2CO3+CaCl2═CaCO3↓+2NaCl)
烧杯1 |
烧杯2 |
烧杯3 |
|
样品溶液(克) |
10 |
20 |
30 |
氯化钙溶液(克) |
30 |
30 |
30 |
沉淀质量(克) |
2 |
4 |
5 |
(3)请写出提高方法一测量精确度的操作建议(写出2条) 。

“84消毒液”是一种常用含氯消毒用品,有效成分是次氯酸钠(NaClO)。使用时,可根据实际需求进行配比,并规范使用,以防引发危险。
(1)“84消毒液”中的有效氯来自次氯酸钠,计算次氯酸钠中氯元素的质量分数。(计算结果精确到0.1%)
(2)现需要5L有效氯浓度为500mg/L的稀溶液,选用有效氯浓度为50000mg/L的某品牌“84消毒液”进行配制,需加水多少升?( 忽略混合前后溶液体积的变化)
(3)“84消毒液”不能与洁厕灵混合使用,因为“84消毒液”里的次氯酸钠与洁厕灵里的盐酸会发生化学反应,产生的氯气对人体有害,不同浓度氯气对人体的影响如表所示。
浓度(mg/m3) |
对人体的影响 |
3000 |
可立即麻痹呼吸中枢,导致瞬间死亡 |
120﹣170 |
极为危险,会引起急性肺水肿及肺炎 |
40﹣60 |
在1小时内便可致人严重中毒 |
通过计算分析,在10米3密闭空间里,若将1.49克次氯酸钠与盐酸完全反应,产生的氯气会对人体造成怎样的影响?(次氯酸钠与盐酸反应的化学方程式为:NaClO+2HCl═NaCl+Cl2↑+H2O)
化学兴趣小组对贝壳中碳酸钙的含量进行探究。
【提出问题】
如何选择药品和设计装置进行测定?
【查阅资料】
贝壳的主要成分是CaCO3,其它成分对实验影响忽略不计。
室温时,CaCO3不溶于水,CaSO4微溶于水。
【设计与实验】
实验一:选择药品
分别取等质量颗粒状和粉末状的贝壳样品与等体积、等浓度的稀盐酸在图1的三颈烧瓶中反应,采集数据。
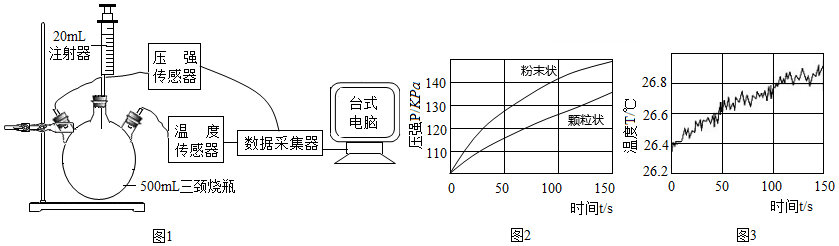
(1)图1中反应的化学方程式是 。
(2)据图2分析,选择粉末状样品的依据是 。
(3)据图3分析,影响实验测定准确性的原因:一是水蒸气含量增加;二是 。
实验二:设计装置

小组设计了图4装置进行测定。
(4)打开活塞,稀硫酸进入试管,观察到的现象是 。反应结束后进行读数。读数前调节水准管与量气管液面相平的原因是 。
实验三:优化装置
在老师指导下,小组优化并设计了图5装置进行测定。
(5)试剂a是 。
(6)检查该装置气密性的方法是 。
(7)加入足量稀硫酸,一段时间后反应停止。再加入氯化铵溶液,发现又产生气泡。推测加入氯化铵溶液的作用是 。
【数据处理】
(8)实验三中,样品质量为mg,加入稀硫酸体积为V1mL,加入氯化铵溶液体积为V2mL,右侧针筒最后读数为V3mL,则反应生成CO2体积为 mL.该实验条件下,CO2密度为dg/mL,则该样品中碳酸钙质量分数表达式为 。
【反思与评价】(9)与实验二相比,实验三的优点是 (写一条)。