(1)某实验小组利用如图实验装置探究二氧化碳的化学性质:
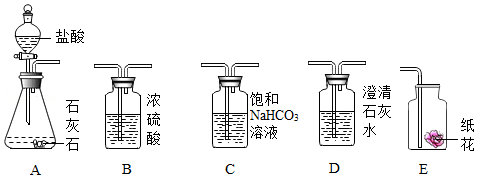
请根据实验装置和实验内容,回答下面问题:
①探究二氧化碳与碱反应时,将装置A生成的二氧化碳气体通入装置D未出现浑浊,原因是 ;可将二氧化碳先通过装置 ,再通入装置D,理由是 (用化学方程式表示);
②探究二氧化碳与水反应时,实验分两步进行:首先将二氧化碳通过石蕊溶液浸泡的干燥纸花,再将二氧化碳通过石蕊溶液浸泡的湿润纸花,这样做的目的是 ;结合上面实验,装置正确的连接顺序是 (填序号)
(2)家庭生活中食品制作(如面条、馒头等)经常用到食用碱,食用碱的主要成分是碳酸钠,可能含有少量氯化钠.小莉将家中食用碱带到实验室进行探究,请设计实验验证小莉提供的食用碱样品是否含有氯化钠.
实验步骤 |
实验现象 |
结论与解释 |
1.取一定量的食用碱样品放入试管,加入蒸馏水、振荡 |
样品溶解 |
食用碱溶于水 |
2. |
|
|
3. |
|
|
蛋白粉是由大豆蛋白、酪蛋白、乳清蛋白或上述几种蛋白混合制成的粉剂,其用途是为营养不良或疾病导致蛋白质缺乏的人群补充营养.请回答:
(1)蛋白粉补充的营养成分是 ;
(2)市售劣质蛋白粉往往添加食用香精、淀粉,从颜色和味道都难以分辨.用少量样品验证这种蛋白粉中含有淀粉的方法是 .

氧化锌广泛用于皮肤病的治疗,工业氧化锌常含有少量杂质(CuO、FeO、SiO2等)不能直接使用。提纯、净化氧化锌的简易流程如图所示:

参考资料:SiO2既不溶于水也不与酸反应
(1)反应器Ⅰ中加入足量稀硫酸,充分反应后,生成硫酸盐的化学式为 ;
(2)残渣中除金属锌外,还有 ;
(3)操作一、操作二和操作三采用的分离方法是 ;
(4)操作四发生反应的化学方程式为 。
如图所示为实验室中常见气体制备、净化、干燥、收集和进行实验探究的部分仪器(组装实验装置时,可重复选择仪器),某化学小组的同学欲利用其进行下列各化学实验。
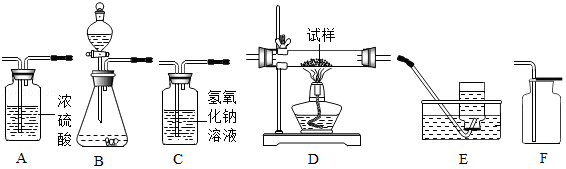
(1)以过氧化氢溶液为原料(二氧化锰作催化剂),在实验室中制备并收集干燥的氧气。按照要求设计实验装置,连接仪器,并检验装置的气密性。
①所选装置的连接顺序为 (从左至右填写装置序号字母)。
②制取氧气所发生反应的化学方程式为 。
③下列有关氧气制取和性质的叙述中,不正确的是 (填写序号A、B、C,D之一)
A.实验室制氧气时,应先加入药品,再检査装置的气密性
B.在此反应前后,二氧化锰的质量和化学性质都不发生改变
C.铁丝在纯氧中剧烈燃烧时,火星四射,生成黑色固体
D.氧气是一种化学性质比较活泼的气体
(2)用干燥纯净的氧气对纤维素的组成进行分析探究实验(资料显示纤维素只含C、H、O三种元素)。所选装置按“氧气→D→A→C→碱石灰干燥管”的顺序连接(实验前检验装置的气密性,假设所发生的化学反应都完全充分进行)。装置D的玻璃管中放入纤维素试样的质量为wg,充分反应后,测得装置A的质量增加ag,装置C的质量增加bg,则纤维素中碳元素的质量分数为 (计算结果用含字母的代数式表示)。
若实验中使用的氧气未干燥,这样测算出的纤维素中碳元素与氢元素的质量比与实际值比较将 (填“偏大”“偏小”“基本一致”“无法确定”之一)
xy1212为浓硫酸洗气瓶,实验前检验装置的气密性,假设所发生的化学反应都充分反应)。进行实验并记录实验数据,如下表所示:
装置编号 |
1中浓硫酸 |
D中玻璃管内固体 |
C中溶液 |
反应前质量 |
150g |
14.4g |
200g |
反应后质量 |
152.7g |
11.2g |
213.2g |
xy中x:y= (填写最简整数比)。
②从环保角度考虑,该实验方案设计还存在不完善之处,你的具体改进方案是 。
南海是我国的固有领海,蕴藏着丰富的海洋资源。2017年5月18日,我国南海神狐海域的可燃冰试采取得圆满成功,实现历史性突破。
(1)可燃冰的主要成分是甲烷。请你写出甲烧在空气中燃烧的化学方程式: 。
(2)可燃冰被科学家誉为“未来能源”“21世纪能源”,原因是 。
23和NaCl的溶解度曲线如图2所示,试回答下列问题:
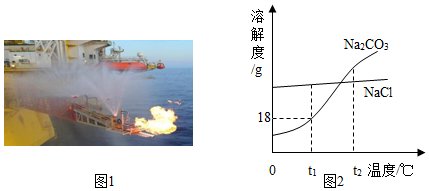
1℃时,NaCl的溶解度 23的溶解度(填写“大于”“等于”“小于”之一)。
123,经充分溶解,所得溶液中溶质与溶液的质量之比为 (填最简整数比)。
12℃,此时所得碳酸钠溶液溶质质量分数 氯化钠溶液溶质质量分数(填写“大于”“等于”“小于”“无法判断”之一)。
实验室有一瓶标签残缺并且瓶盖没有完全密封的无色溶液(如图),化学小组的同学经过寻问老师后只知道是NaCl、NaOH、Na2CO3、NaHCO3中的一种溶液,为确认原瓶中是何种溶质并判断其是否变质,化学小组的同学进行了如下的探究活动:
[进行猜想]
猜想I:原溶液的溶质是NaCl;
猜想II:原溶液的溶质是NaOH;
猜想III:原溶液的溶质是Na2CO3;
猜想IV:原溶液的溶质是NaHCO3。
[查阅资料]
常温下,有关物质的相关信息如下表:
物质 |
NaCl |
NaOH |
Na2CO3 |
NaHCO3 |
常温下的溶解度/g |
36 |
109 |
21.5 |
9.6 |
常温下稀溶液的pH |
7 |
13 |
11 |
9 |
从物质的相关信息可知,原溶液的溶质一定不是NaHCO3,因为 。
[进行实验]
(1)取少量样品,测得溶液的pH大于7,则原溶液的溶质肯定不是 。
(2)同学们另取样品又进行了如下实验,实验过程如下:
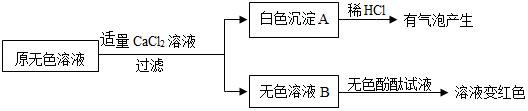
①生成白色沉淀A的化学方程式 。
②通过实验可以判断样品无色溶液中含有的溶质有
[获得结论]
实验完成后,最终得到的结论:原瓶中的溶质是 ,且已变质。
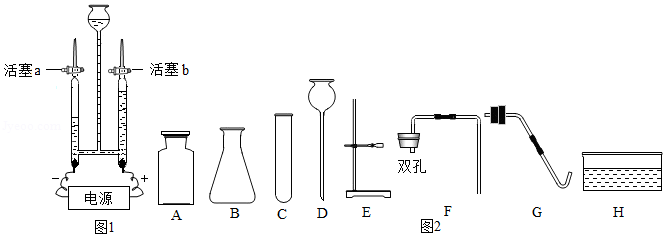
化学实验室制取气体的部分仪器或装置如图所示,请回答下列问题。 
(1)仪器B的名称: 。
(2)若用氯酸钾和二氧化锰制取氧气,必须要增加的一种仪器是 ;该反应的化学方程式为: 。若用装置H收集氧气,氧气应从 (填"a"或"b")端通入。
(3)若要组装一台制取并收集二氧化碳气体的装置,可选择的装置组合为 (填字母,写一种组合即可)。
(4)某同学用上述(2)中的方法制取氧气,实验过程中试管发生了炸裂,请你帮他分析试管炸裂可能的原因是 。(写一条即可)
下列初中化学常见的几种物质相互转化关系图,其中B为黑色固体,N为蓝色沉淀,其中部分生成物和反应条件已略去。

请回答:
(1)D的化学式为 。
(2)B→A的化学方程式为 。
(3)C和F反应的化学方程式为 ,其基本反应类型为 。
2017年5月5日,我国国产大型客机C919在上海浦东机场首飞成功,标准着我国航空事业有了最大突破.结合所学知识回答下列问题:
(1)大型客机大量使用了铝锂合金、钛合金等,其原因是合金比纯金属具有 .
(2)空气中,铝比铁具有更好的抗腐蚀性.原因是 (用文字叙述).
(3)已知金属M和N能够发生如下反应:Fe+MCl2=M+FeCl2,N+FeCl2=Fe+NCl2,判断Fe、M、N三种金属的活动性由强到弱的顺序是 .
20℃时,将等质量的甲、乙两种固体分别加入盛有100g水的烧杯中,充分搅拌后现象如图1所示,甲、乙两物质的溶解度曲线如图2所示。请回答下列问题:

(1)图l中一定为饱和溶液的是 溶液(填“甲”或“乙”)
(2)图2中P点表示的意义 。
(3)图2中表示乙物质溶解度曲线的是 (填“M”或“N”)
用适当的化学用语填空
(1)2个氮气分子 ;(2)+5价的磷形成的氧化物
(3)硝酸中的阴离子 ;(4)常用于改良酸性土壤的碱 .
[实验回顾]18世纪末,英国科学家普利斯特里和卡文迪许把“易燃空气”与空气或氧气混合后盛在干燥、洁净的玻璃瓶中,当用电火花点火时,发出震耳的爆鸣声,且玻璃瓶内壁上出现了液滴.一年之后,拉瓦锡重复了他们的实验,并做了一个相反的实验:让水蒸气通过一根烧红的枪管,得到了“易燃空气”,这里的“易燃空气”是指 (填化学式),通过上述实验得到的结论是 。
[实验重现]某化学兴趣小组的同学在创新的基础上,在实验室中重做上述两个实验,做法如下:
实验1:水的通电分解实验
如图1所示,打开活塞b,用燃着的木条在玻璃管尖嘴口检验反应产生的气体,看到的现象是 ,证明该气体为 .
实验2:“易燃空气”与氧气混合后的点燃实验
实验室现有过氧化氢溶液、氯酸钾、二氧化锰、稀硫酸、锌粒,如图2是实验室常用部分仪器:
(1)指出图中仪器的名称:D .
(2)利用上述仪器和药品制取少量氧气,其简易发生装置应选择的仪器有 (填序号),反应的化学方程式为 .
(3)利用上述仪器和药品制取较多量的“易燃空气”,且可以随时补充液体,你选择的仪器有 (填序号),药品是 .该兴趣小组的同学把“易燃空气”与氧气按一定比例混合后盛在干燥、洁净的玻璃瓶中,用电火花点火,顺利完成上述实验.
(4)该兴趣小组的同学决定利用制得的“易燃空气”和空气继续进行探究,他们取7支试管,依次盛水90%(体积分数),80%…再用排水集气法收集“易燃空气”,而后分别把试管口移近酒精灯的火焰,实验结果如表所示:
序号 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
“易燃空气”体积分数(%) |
90 |
80 |
70 |
50 |
20 |
10 |
5 |
空气体积分数(%) |
10 |
20 |
30 |
50 |
80 |
90 |
95 |
点燃现象 |
安静燃烧 |
安静燃烧 |
弱的爆鸣声 |
强的爆鸣声 |
强的爆鸣声 |
弱的爆鸣声 |
不燃烧 不爆鸣 |
分析表中信息,完成下列问题:
①在混合气体爆炸范围内,“易燃空气”的体积分数约为 .
②你对燃烧或燃烧条件的新认识是 .
化学实验过程中要规范操作,注意安全.下列有关做法错误的是 .
A、稀硫酸沾到皮肤或衣物上,如果浓度不大,可暂不处理,或用水冲洗一下即可
B、实验室中的药品经确认无毒无害的,可以品尝一下以感受其味道
C、给烧杯中的液体加热时,烧杯下面必须垫石棉网
D、称量药品时,为避免药品腐蚀托盘,应将药品放在纸上称量
E、对于溶解时没有明显热量变化的液体,可用量筒完成溶液的配制
F、实验完毕后,应及时洗涤所用的器皿,仪器、药品归类整理,放在规定的位置.
化学兴趣小组为验证质量守恒定律,做了镁条在空气中燃烧的实验(如图1),同学们观察到镁条在空气中剧烈燃烧,发出耀眼的强光,产生的大量白烟弥漫到空气中,最后在石棉网上得到一些白色固体。

(1)请写出镁条燃烧的化学方程式 ;
(2)同学们通过称量发现:在石棉网上收集到产物的质量小于镁条的质量,有人认为这个反应不遵循质量守恒定律。你认为出现这样实验结果的原因可能是: ;
(3)小红按图2装置改进实验,验证了质量守恒定律,还发现产物中有少量黄色固体。
[提出问题]黄色固体是什么?
[查阅资料]①氧化镁为白色固体;②镁能与氮气剧烈反应产生黄色的氮化镁(Mg3N2)固体;③氮化镁可与水反应产生氨气,该气体能使湿润的红色石蕊试纸变蓝。
[做出猜想]黄色固体是Mg3N2
[实验探究]请设计实验,验证猜想
实验操作 |
实验现象及结论 |
|
|
[反思与交流]①氮化镁中氮元素的化合价是 ;
②空气中N2的含量远大于O2的含量,可是镁条在空气中燃烧产物MgO却远多于Mg3N2,合理的解释是: 。
③同学们又联想到氢气在氯气中能够燃烧,于是对燃烧条件又有了新的认识: 。