铝碳酸镁咀嚼片(主要成分是 )可治疗胃酸过多症,反应原理可用化学方程式表示为 。某化学兴趣小组使用如图所示装置,对该咀嚼片中的铝碳酸镁含量进行测定。先取足量稀盐酸于烧杯中,再向其中加入 片铝碳酸镁咀嚼片,开始计时,并将电子天平的读数记录在下表中。已知 的相对分子质量为 。请计算:
时间( ) |
|
|
|
|
|
|
|
|
读数( ) |
|
|
|
|
|
|
|
|
(1)生成二氧化碳____ 。
(2)每片该咀嚼片中铝碳酸镁的含量为多少(计算结果保留到 )?

钙在冶炼工业中具有重要的作用。可采用电解熔融氯化钙的方法生产钙,反应的化学方程式为
 。若制得
,计算参加反应的
的质量(写出计算过程及结果)。
。若制得
,计算参加反应的
的质量(写出计算过程及结果)。
纯碱可用于造纸、玻璃生产等领域。纯碱产品中常含有少量的氯化钠杂质,某兴趣小组的同学为测定某品牌纯碱样品中碳酸钠的质量分数,设计了如图方案并进行实验。
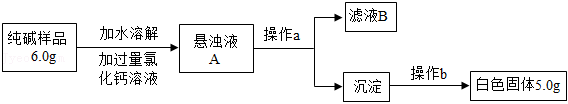
(1)滤液 中含有的阳离子有 __________(填化学符号)。
(2)若沉淀不经过操作 会使测定结果 _____(填“偏大”、“偏小”或“无影响”)。
(3)根据以上数据计算该样品中碳酸钠的质量分数(写出计算过程,结果精确至 )。
氮肥有促进植物茎、叶生长茂盛,叶色浓绿,提高植物蛋白质含量的作用。 是一种常见的氮肥,请计算:
(1) 的相对分子质量_____;
(2) 中氮元素的质量分数_____(精确到 )。
化肥对提高农作物的产量具有重要作用,尿素 是最常见的化肥之一。
(1)尿素属于_____(填标号)。
| A. | 氮肥 |
| B. | 磷肥 |
| C. | 钾肥 |
| D. | 复合肥 |
(2)尿素中氮元素的质量分数是_____ (结果保留到小数点后一位)。
(3)工业上生产尿素的反应为 。若生产 尿素,理论上需要氨气的质量是多少?(写出计算过程)

粮食安全是国家安全的重要基础,化肥对提高粮食产量有重要作用。尿素【
】是常用的氮肥之一,可促进植物茎、叶生长茂盛,叶色浓绿,提高植物蛋白质含量。已知:

(1)尿素中氮元素的质量分数为_____(结果精确到 )。
(2)巴中某农业合作社需要 吨尿素,请计算合成这些尿素需要 的质量是多少吨。(写出计算过程)
已知某种钾肥是 和 的混合物,为测定二者的质量比,在烧杯里放入一定质量的该钾肥样品,加入适量水,完全溶解后,再向其中加入 溶液至恰好完全反应,得到 溶质质量分数为 的 溶液,并生成 白色沉淀。
请计算:
(1)该钾肥样品中钾元素的质量。
(2)该钾肥样品中 与 的质量比(用最简整数比表示)。
小华同学为测定某稀盐酸中溶质的质量分数,在烧杯里放入一定质量的大理石,然后分次加入该稀盐酸,充分反应后测得生成二氧化碳的质量如表所示(大理石中的杂质不参与反应)。
加稀盐酸的次数 |
第一次 |
第二次 |
加稀盐酸的质量/g |
25 |
25 |
生成二氧化碳的质量/g |
2.2 |
1.1 |
(1)两次加稀盐酸后,生成二氧化碳的总质量是 g。
(2)计算该稀盐酸中溶质的质量分数(计算结果保留至0.1%)。
北京冬奥会最大的特点之一是“绿色环保”。运动员使用的可降解聚乳酸一次性餐具是以乳酸( )为主要原料得到的聚酯类聚合物。请你计算:
(1)乳酸中碳、氢、氧元素的质量比为 。
(2)乳酸中碳元素的质量分数为 。
某化学兴趣小组欲测定某石灰石样品中碳酸钙的质量分数,先将10g样品放入烧杯中,再把100g稀盐酸分5次加入该样品中(该实验条件下,杂质不与酸反应,也不溶解于水,忽略稀盐酸挥发),得实验数据如表格。
稀盐酸的质量 |
充分反应后剩固体的质量 |
第一次加入20g |
8g |
第二次加入20g |
6g |
第三次加入20g |
4g |
第四次加入20g |
2g |
第五次加入20g |
2g |
请计算;
(1)10g石灰石样品中碳酸钙的质量分数是 。
(2)求稀盐酸的溶质质量分数(写出计算过程,结果精确到0.1%)。
N4O6是科学家发现的一种新型火箭燃料。试计算:
(1)N4O6中氮元素和氧元素的质量比是 (最简整数比)。
(2)152g N4O6中氮元素的质量是 g。
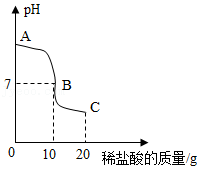
常温下,一锥形瓶中盛有10g溶质质量分数为4%的氢氧化钠溶液,先向其中滴加2滴酚酞试液,再逐滴滴加一定溶质质量分数的稀盐酸,用pH传感器测得溶液pH与加入稀盐酸的关系曲线如图所示,请回答下列问题:
(1)图中B点溶液呈 色。
(2)计算稀盐酸中溶质质量分数。(写出计算过程)
孔雀石的主要成分是Cu2(OH)2CO3,还含有Fe2O3、Al2O3、SiO2杂质,用该矿石制备Cu的流程如图所示(部分产物略去):
 (1)过程①中,操作a是溶解和 ,还有一种气体产物是 ,滤液X中含有的金属阳离子为 。
(1)过程①中,操作a是溶解和 ,还有一种气体产物是 ,滤液X中含有的金属阳离子为 。
(2)过程①中硫酸略过量,则过程②调pH除杂的最佳试剂是 (选填“CuO”或“Na2CO3”)。
(3)下列关于制取铜的两种方案的说法,正确的是 。
A.“方案一”得到的铜产品更纯
B.“方案一”不存在消耗能量的问题
C.“方案二”需考虑废气污染的问题
D.“方案二”得到纯铜的产率更高
(4)过程③发生的反应:2CuSO4+2H2O 2Cu+O2↑+ (补充完方程式),当收集到800t氧气时,产生Cu的质量是多少?(写出必要的计算过程)
2Cu+O2↑+ (补充完方程式),当收集到800t氧气时,产生Cu的质量是多少?(写出必要的计算过程)
某石灰水中含有氢氧化钙1.48g,要使该石灰水中的氢氧化钙转化为碳酸钙沉淀,至少需要二氧化碳的质量是多少?