现有200 溶质质量分数为10%的硝酸钾溶液,若使溶液的溶质质量分数增加一倍,因向溶液加入硝酸钾 ,或蒸发掉水 。
26 黄铜( 合金)与100 稀硫酸在烧杯中恰好完全反应,反应后测得烧杯中剩余物的总质量为125.8克。求:
⑴黄铜中铜的质量分数;
⑵反应后所得溶液中溶质质量分数。(计算结果精确到0.1%)
实验室常用右下图所示装置测定空气中氧气含量。
(1)若有1.24
红磷发生反应,则根据化学方程式计算,产生的固体(
)有多少克?
(2)该试验中红磷过量,你认为是否有道理?(填"是"或"否"),你的理由是。
(3)在动手实验的过程中,你认为该实验的不足是(至少一条)
在实验室易燃品橱柜里有一瓶失去标签的试剂,某化学兴趣小组三位同学为探究其组成,进行如下实验并进行分析:
(1)甲同学取物质3.6g在足量的氧气中燃烧。经测定得到5.4g水和11g二氧化碳,通过计算求出5.4g水中含氢元素 g,11g二氧化碳中含碳元素 g。
(2)乙同学分析了乙同学的计算结果,认为还可以计算出该物质中碳、氢元素的原子个数比是 。
碘元素(符号为 I)具有预防和治疗甲状腺肿的作用,人体缺碘时易患粗脖子病。结合右图标签请回答下列问题:
(1)已知碘酸钾的化学式为KIO3,则
①碘酸钾中碘的化合价为_________;
②碘酸钾相对分子质量为___________;
③碘酸钾中碘元素的质量分数为______________ ;
④________克碘酸钾中含有 20 mg 碘?
(2)由食用方法和贮藏方法可推测碘酸钾的化学性质之一是______________________________________________________________。
(3)若 1000 g 碘盐中约含 20 mg 碘。
①这里标明的碘的含量是指:( )
| A.碘单质 | B.碘元素 | C.碘原子 | D.碘分子 |
②已知成人每天约需0.15g碘,假设这些碘主要是从碘盐中摄取的,则成人每天需要食用碘盐______________g。
如图是一袋化肥标签的一部分,
请回答:
(1)CO(NH2)2的相对分子质量为:____________
(2)CO(NH2)2中各元素的质量比为C∶O∶N∶H =__________
(3)CO(NH2)2中N元素的质量分数为:___________(保留一位小数)
(4)一位农民计划施加2 kg该化肥,则给农作物施加的N元素质量为:____________kg。
(5)该袋化肥中尿素的质量分数为:____________(保留一位小数)
联合国将2011年定为“国际化学年”。本次“国际化学年”的主题是“化学,人类的生活,人类的未来”,以鼓励青年人热爱化学,庆祝国际化学联合会和居里夫人在化学领域为人类文明进步所作出的重要贡献.
(1)下列安排属于本次“国际化学年”系列活动的是 ▲
A、纪念居里夫人获诺贝尔奖100周年的庆祝活动
B、庆贺国际化学联合会成立恰逢100周年的活动
C、开展多种形式鼓励青年人热爱化学的宣传活动
D、消除将掺杂制假的重大食品安全问题怪罪于化学的偏见
(2)科学家发现月球表面陨石坑中存在固态的①H2O,还有②Hg、③NH3、④CH4等物质,其中属于单质的是 ▲ (填序号),属于氧化物的是 ▲ (填序号)。如果除Hg以外的其余三种物质按照H2O、NH3、CH4的顺序排列,则排列的依据是 ▲ (写一种即可)。
(3)为了积极配合参与“国际化学年”活动,北京大学校长、著名的高分子化学家周其凤亲自作词创作了歌曲《化学是你,化学是我》,并在网络中广为流传。其中有这样两句歌词:“记忆和思维活动,要借化学过程来描摹;即便你我的喜怒哀乐,也是化学神出鬼没。”例如多吃香蕉能使人快乐,原因是香蕉中含有一种能帮助人脑产生羟色胺的物质,能使人的心情变得愉悦,羟色胺的化学式为C10H12N2O。请回答下列问题:
①羟色胺由 ▲ 种元素组成,羟色胺中C、H、N、O各元素质量比为 ▲ 。(请写出具体计算过程,并注意格式,下同)
②羟色胺中氮元素的质量分数为 ▲ (结果保留至0.1%)
③50g羟色胺中含氮元素的质量为多少?(结果保留至0.1g)
人体缺乏维生素C(简写“VC”)就会患坏血病,哥伦布探险时的许多船员就因此而死亡.如图所示为某种“维生素C”说明书的一部分.请你回答: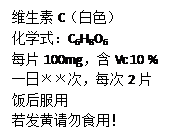
(1)“VC”的相对分子质量为 ;
(2)若正常成人每天对“VC”的最低需要量为60mg.当“VC”完全来自右图的“维生素C”,则每天至少服用 次。
青少年正处于生长发育时期,每天需要摄取足量的蛋白质,蛋白质的代谢产物中含有尿素。〔尿素的化学式为CO ( NH2 ) 2〕请根据尿素的化学式计算(只写结果):
(1)尿素中含有 种元素,其中碳元素和氮元素的质量比为 ;
(2) 尿素中氮元素的质量分数为 ;
(3) 120g尿素与 g硝酸铵(NH4NO3)所含氮元素的质量相等。
已知标准碳原子的质量是1.993×10-26kg,而1个铁原子的质量是9.288×10-26kg,求铁原子的相对原子质量(精确0.01)。
有一种石灰石样品的成分是CaCO3和SiO2。课外小组同学将100g盐酸分5次加入到35g石灰石样品中(已知SiO2不与盐酸反应),得到如下部分数据和图象。
| 次数 |
第1次 |
第2次 |
第3次 |
| 加入盐酸的质量/g |
20 |
20 |
20 |
| 剩余固体的质量/g |
30 |
a |
20 |
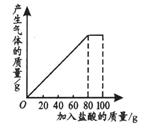
请计算:
(1)第2次加入盐酸后,a为 g。
(2)石灰石样品中钙元素、碳元素和氧元素的质量比为多少?(结果用最简整数比表示)
(3)10%的CaCl2溶液可作路面保湿剂。欲将第5次实验后的溶液配成10%的CaCl2溶液,可先向此溶液中加入足量的石灰石粉末,完全反应后过滤,这时还需要向滤液中加入水多少克?(假设实验过程中溶液损失忽略不计)
(4分)低钠盐适合患有高血压、肾病、心脏病的患者服用,苹果酸钠盐(C4H5O5Na)是低钠盐的一种。请回答:
⑴苹果酸钠盐的相对分子质量是 。
⑵苹果酸钠盐中各元素的质量比为 。
⑶若某病人每天食用4.68g苹果酸钠盐,与食用多少克食盐(NaCl)摄入钠元素的质量相同?(计算结果保留一位小数)
有一置于水中用特殊材料制成的密闭容器,气体分子可以通过该容器的器壁,而液体和固体则不能通过。容器质量为1g,体积为0.04L。容器内盛有32.5g质量分数为40%的稀硫酸,如果向其中加入锌粒,要想保持容器在水底不沉底,则锌粒的质量最大不能超过多少?
(4分) 儿童缺锌会引起食欲不振、发育不良.右图为某种补锌口服液说明书的一部分.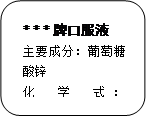
请回答:
(1)该口服液中的锌属于 ▲ (填:“常量”或“微量”)元素;
(2)计算组成葡萄糖酸锌中的碳、氢元素的质量比?
(3)计算葡萄糖酸锌中碳元素的质量分数为多少?(精确到0.1%)
(4)若儿童1kg体重每日需要0.5mg锌,每天从食物中只能摄入所需锌的一半;体重为20kg的儿童每天还须服该口服液 ▲ 支,才能满足身体的需要.