为从定量角度认识中和反应,小明同学自行设计并进行了下面实验:
①在小烧杯中倒入8%的氢氧化钠溶液l0g,滴入2滴酚酞试剂后,溶液呈红色;
②另取10%的稀盐酸逐滴滴加到氢氧化钠溶液中,边滴边振荡,随盐酸滴入,溶液颜色逐渐变浅;
③在溶液红色消失瞬间,停止实验。
若停止实验时,两溶液恰好反应。请分析小明实验后回答:
(1)实验中酚酞试剂的作用是__________________________;
(2)计算出这时共用去稀盐酸的质量是多少?(精确到0.1)
某同学为了测定一瓶过氧化氢溶液中溶质的质量分数,取该溶液20g,加入二氧化锰0.5g,完全反应后,称得烧杯内剩余物质的总质量为19.7g。请回答下列问题:
(1)二氧化锰在反应中的作用是__________________。
(2)计算该过氧化氢溶液中溶质的质量分数。
(3)利用上述溶液配制100g溶质质量分数为3%的过氧化氢消毒液,需该溶液的质量为__________g(结果保留一位小数)。
如下图所示,实验室用过氧化氢溶液和二氧化锰制取氧气,实验的相关数据如下表。
| |
气体发生装置内物质的总质量 |
| 反应前 |
35.6 |
| 反应后 |
34.8 |
(l)反应中二氧化锰的作用是 。
(2)反应生成氧气的质量为 g(结果精确到0. 1 g,下同)。
(3)计算参加反应的过氧化氢的质量,写出必要的计算过程。
实验室里可用锌与稀硫酸反应制取氢气:
Zn + H2SO4 = ZnSO4 + H2↑
某实验需要氢气2.24L。
(1)求参加反应的锌的质量。
(2)某兴趣小组用的是从废旧电池中得到的含杂质10%的锌皮制取氢气。现有这种废锌皮15g,与足量稀硫酸反应,最多得到氢气多少g?
实验室用分解高锰酸钾制氧气。若31.6g高锰酸钾完全分解可制得多少氧气?同时得到多少克二氧化锰?
鸡蛋壳的主要成分是碳酸钙,某兴趣小组为了测定鸡蛋壳中CaCO3的含量,现取15g鸡蛋壳,捣碎,放在烧杯中,然后向其中加入80g某浓度的稀盐酸,使之充分反应(鸡蛋壳中除CaCO3外的其他成分都不溶于水,且不与稀盐酸反应),测得烧杯中的反应剩余物的质量(m)与反应时间(t)的关系如图所示(忽略水蒸气的挥发),其中当反应进行到B点时,所用盐酸刚好消耗了加入量的一半,试计算(计算结果保留1位小数)
(1)产生CO2的质量为 g;
(2)该鸡蛋壳中CaCO3的质量分数;
(3)所用稀盐酸中溶质的质量分数;
65克锌与260克稀硫酸恰好完全反应,发生的化学方程式为Zn+H2SO4═ZnSO4+H2↑,试计算:
有73克10%的盐酸溶液,若用20%的氢氧化钠溶液来完全中和上述盐酸,通过计算,需加入氢氧化钠溶液质量多少克?
我国很早就掌握了湿法炼铜,其反应的化学方程式为:Fe+CuSO4═FeSO4+Cu计算炼出32kg的铜需要铁质量为 。
碳酸钙高温分解可得到氧化钙,该反应化学方程式CaCO3 CaO+ CO2↑
CaO+ CO2↑
现有200g碳酸钙,可得氧化钙 克?
写出碳在高温时还原氧化铜的化学方程式,并计算要使80g氧化铜完全还原,需要碳的质量至少是 g
钢铁厂购进含氧化铁85%的赤铁矿1000t,准备用这些铁矿石炼取含杂质3%的生铁,请利用化学方程式计算生铁的质量 (计算结果保留整数)
造纸厂会产生含氢氧化钠的废水,需经处理呈中性后排放。为测定此废水中氢氧化钠的质量分数,工作人员取了40g废水样品加入到锥形瓶中,逐滴加入10%的稀硫酸,至恰好完全反应时,消耗稀硫酸49 g。计算废水中氢氧化钠的质量分数。
某课外活动小组加热炭粉(过量)和氧化铜的混合物,再用下图所示装置,对获得的铜粉(含炭)样品进行实验,测定铜的质量分数。图中铁架台等装置已略去。请回答下列问题: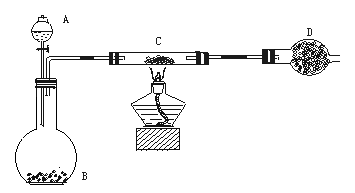
仪器:铁架台(含铁圈、铁夹)、分液漏斗、平底烧瓶、硬质玻璃管、干燥管、酒精灯、石棉网、洗气瓶等。
药品:红褐色(含炭)样品、过氧化氢溶液、二氧化锰、碱石灰(固体氢氧化钠和氧化钙的混合物,可用来吸收水和CO2)。
(1)除上述仪器外,实验中还必须用到的仪器是 ;
(2)实验操作前,首先进行 检查。在C中加入样品粉末W g,D中装入药品后并称量为m1 g,连接好仪器。打开A的上塞、活塞,慢慢滴加溶液。对C进行加热。当C中药品充分反应后,关闭A的活塞,停止加热。冷却后,称量D的质量为m2 g。 实验进行的过程中,装置C中发生的主要化学反应类型 ;充分反应后装置C中剩余的固体成分是 。
(3)问题和讨论:
实验完成后,老师评议说:按上述实验设计,即使C中反应完全,D中吸收完全,也不会得出正确的结果。经讨论,有同学提出在B与C之间加入一个装置,该装置作用是 。
(4)有学生提出直接用右图装置,在空气中直接加热进行实验。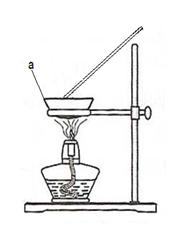
图中仪器“a”的名称为 。
若取20g铜粉(含炭)样品进行实验,充分反应后,仪器a中剩余的固体质量为24g,计算求原来混合物中铜的物质的量以及铜的质量分数。
(要求:根据化学方程式计算,并写出计算过程!)