取一氧化碳还原氧化铜实验的固体残留物20g,向其中加入稀硫酸,剩余固体质量与加入稀硫酸质量关系如图所示,请回答下列问题。
(1)所取固体残留物中铜的质量为 g。
(2)求a点处溶液中溶质的质量分数(写出计算过程)。

某同学将一定量的二氧化碳通入到200g过量的氢氧化钠溶液中,反应后得到208.8g混合溶液。(反应的化学方程式是:2NaOH+CO2═Na2CO3+H2O)
(1)参加反应的二氧化碳的质量是 g。
(2)求反应后混合溶液中碳酸钠的质量分数。(写出计算过程,计算结果精确到0.1%)
某公司生产出的纯碱经检测只含有氯化钠杂质。为测定该纯碱样品中碳酸钠的质量分数,称取26.5g该样品,加入到盛有一定质量稀盐酸的烧杯中,恰好完全反应。反应过程中测得烧杯内混合物的质量(m)与反应时间(t)的关系如图所示。试分析并计算:
(1)生成CO2的质量为 。
(2)该纯碱样品中Na2CO3的质量分数。
将50.0g盐酸、氯化镁和氯化铝的混合溶液置于烧杯中,逐滴加入质量分数为20.0%的氢氧化钠溶液,生成氢氧化铝沉淀的最大质量为7.8g。加入氢氧化钠溶液质量和生成沉淀质量的关系如图所示。请根据题意回答问题:
已知:Al(OH) 3+NaOH═NaAlO 2+2H 2O
(1)B点溶液中所含溶质是 (填化学式)。
(2)求图中A点的坐标: 。
(3)原混合溶液中MgCl 2的质量分数是多少?(写出计算过程,计算结果精确到0.1%)

小明用石灰石测定某稀盐酸中溶质的质量分数,向盛有100g稀盐酸的烧杯中依次加入石灰石粉末(杂质不参加反应),充分反应后,记录实验数据见下表。请计算:
| 实验次数 |
第一次 |
第二次 |
| 石灰石粉末质量/g |
15 |
15 |
| 烧杯中物质总质量/g |
109.5 |
121.2 |
(1)共生成二氧化碳 g。
(2)所用稀盐酸中溶质的质量分数。
绿色环保是未来工业发展的方向,我市锰矿资源丰富,某电解锰厂排放的废液中可能含有少量硫酸,某校兴趣小组同学取该废液样品100g,加入某碱性M物质充分反应后得到的相关数据如图(废液中其它物质不与M物质反应)。请根据相关知识和图表信息回答下列问题。
(1)从经济和效果考虑,该电解锰厂应选择什么物质除去废液中硫酸?
(2)该反应的基本类型是 。
(3)计算废液中硫酸的质量分数(写出计算过程)。

某化学兴趣小组的同学在社会实践中,对废品回收站中废弃电器零部件黄铜(铜、锌合金)中铜的含量产生了兴趣,为了测定该黄铜中铜的含量,小组同学将黄铜带入化学实验室,称取该黄铜样品50克放入指定容器中,然后分四次加入稀硫酸,实验数据记录如表:
| 加入次数 |
第1次 |
第2次 |
第3次 |
第4次 |
| 加入稀硫酸质量(g) |
100 |
100 |
100 |
100 |
| 充分反应后剩余固体质量(g) |
43.5 |
37 |
35 |
n |
请回答下列问题:
(1)根据实验数据分析,n的数值应该为 ;
(2)黄铜样品中铜的质量分数为 ;
(3)所用稀硫酸溶质的质量分数。(写出计算过程)
现有碳酸钾和氯化钾的固体混合物15.8g,将88.6g稀盐酸加入到固体混合物中,恰好完全反应,得到100g溶液。请计算:
(1)反应生成的气体的质量为 。
(2)混合固体中碳酸钾的质量为 。
(3)计算反应后溶液中溶质的质量分数。(写出计算过程)有
请根据所示的实验过程和提供的信息作答:
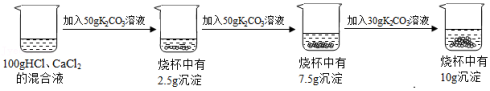
(1)K2CO3中钾、碳、氧元素的质量比为 (写最简比)。
(2)实验结束后溶液中的溶质为 。
(3)实验所用K2CO3溶液的溶质质量分数为 (精确至0.1%)。
(4)计算原混合液中CaCl2的质量分数。(写出计算过程,精确至0.1%)
胆矾(CuSO4•5H2O,相对分子质量为250)广泛应用于生产生活中。
(1)农药波尔多液由胆矾和石灰乳等配制而成。不能用铁桶来配制波尔多液,因为铁的金属活动性比铜的 (填“强”或“弱”)。
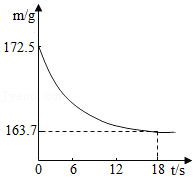
(2)将25.0g胆矾放在坩埚内加热,固体质量与成分随温度变化的曲线如图。
①加热至 ℃时,CuSO4开始分解。
②加热至1000℃时,CuO开始分解,生成Cu2O与一种能使带火星的木条复燃的气体,该气体为 。CuO完全分解时产生该气体的质量为 g。
③根据胆矾分解的化学方程式CuSO4•5H2O CuSO4+5H2O,计算图中x的值(写出计算过程)。
CuSO4+5H2O,计算图中x的值(写出计算过程)。
④下列物质均可作为炼铜的原料。理论上,冶炼等质量的下列物质得到铜最多的是 (填字母序号)。
a.CuSO4•5H2O
b.CuSO4
c.CuO
d.Cu2O

我国化学家侯德榜创立了侯氏制碱法,为世界制碱工业作出了杰出贡献。在实际生产的产品碳酸钠中会混有少量的氯化钠。现有纯碱样品,为测定该样品中碳酸钠的质量分数,已称取样品6g,放入40g水中使其完全溶解,再加入稀盐酸26.2g,恰好完全反应,气体全部逸出,得到氯化钠的不饱和溶液70g。请计算(写出简要的计算过程):
(1)生成二氧化碳的质量。
(2)样品中碳酸钠的质量。
(3)反应后所得溶液中溶质的质量分数(计算结果精确到0.1%)。
《天工开物》中记载了金属的冶炼技术。在锌的冶炼方法中,主要反应之一为ZnO+CO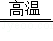 Zn+CO2。若制得65kgZn,计算参加反应的ZnO的质量(写出计算过程及结果)。
Zn+CO2。若制得65kgZn,计算参加反应的ZnO的质量(写出计算过程及结果)。
人体所需的维生素C(化学式为C 6H 8O 6)主要从蔬菜、水果中摄取,计算:
(1)维生素C中碳、氢、氧三种元素质量的最简整数比为 。
(2)现有溶质质量分数为1%的维生素C的溶液300g,若配制成溶质质量分数为0.3%的维生素C的溶液,问需要加水的质量是多少。(写出计算过程)
小苏打(NaHCO 3)是发酵粉的主要成分,可用于制作发面食品。化学兴趣小组为测定某品牌小苏打样品(含NaCl杂质)中碳酸氢钠的含量做了如下实验:将该样品17.1g放入锥形瓶中,加水全部溶解后,得到208.8g样品溶液,向该样品溶液中不断加入稀盐酸(如图),反应过程中锥形瓶中溶液质量的变化如下表所示。(忽略CO 2在水中的溶解)
| 加入稀盐酸的总质量/g |
25 |
50 |
75 |
| 锥形瓶中溶液的质量/g |
229.4 |
250 |
275 |
试计算:
(1)当加入25g稀盐酸时,产生二氧化碳的质量是 g。
(2)17.1g小苏打样品中NaHCO 3的质量(写出计算过程,下同)。
(3)当锥形瓶内样品溶液中的碳酸氢钠与加入的稀盐酸恰好完全反应时,锥形瓶中溶液的溶质质量分数。(计算结果精确至0.1%)

洁厕灵的有效成分为HCl,李强同学测定某品牌洁厕灵中HCl的质量分数。他将100.0g洁厕灵倒入锥形瓶中,逐次加入等质量相同质量分数的Na 2CO 3溶液,测出每次完全反应后溶液的总质量,实验数据记录如表。
| |
第一次 |
第二次 |
第三次 |
第四次 |
第五次 |
| 加入Na 2CO 3溶液的质量/g |
20.0 |
20.0 |
20.0 |
20.0 |
20.0 |
| 反应后溶液的总质量/g |
118.9 |
137.8 |
M |
175.6 |
195.6 |
请根据实验数据分析解答下列问题。
(1)表格中M的数值为 ;
(2)恰好完全反应时消耗Na 2CO 3的质量是多少?
(3)该洁厕灵中HCl的质量分数是多少?